«Splendor in the grass» es el nombre de un reciente estudio de la Universidad de Harvard. El estudio indica que contrario a la creencia popular desprendida del prohibicionismo, de que la marijuana mata las neuronas, más bien esta funciona como neuroprotectora y previene la degeneración del cerebro, e incluso mejoraría sus funciones.
De los cientos de compuestos químicos presentes en la cannabis, el cannabigerol y la tetrahidrocannabivarina se consideran los principales neurogénicos y/o neuroprotectores. El estudio se realizó durante un período de un año. Participaron 32 sujetos que fueron examinados a los tres, seis y finalmente a los doce meses.
Después de solo tres meses de tratamiento médico con marihuana, los participantes mostraron un aumento en su capacidad para completar cualquier prueba de precisión o velocidad, lo que sugiere que los tratamientos con el tiempo aumentan la función cerebral.
Tras los primeros resultados se seguirán explorando los efectos de la cannabis en las habilidades cognitivas y el comportamiento para confirmar lo expuesto. De confirmarse las conclusiones de este estudio se demostraría que la prohibición de la cannabis en el mundo no estaría justificada.
A continuación dejamos a vuestra disposición el estudio mencionado:
¿Esplendor en la hierba? Un estudio piloto que evalúa el impacto de la marihuana medicinal en la función ejecutiva.
Autores: Staci A. Gruber 1, 2*, Kelly A. Sagar 1, 2, Mary K. Dahlgren1, 3, Megan T. Racine1 Rosemary T. Smith1 and Scott E. Lukas 2, 4
1 Cognitive and Clinical Neuroimaging Core, McLean Hospital Imaging Center, Belmont, MA, USA,
2 Department of Psychiatry, Harvard Medical School, Boston, MA, USA,
3 Department of Psychology, Tufts University, Medford, MA, USA,
4 Behavioral Psychopharmacology Research Laboratory, McLean Hospital Imaging Center, McLean Hospital, Belmont, MA, USA
Actualmente, 25 estados y Washington DC han promulgado programas completos de marihuana medicinal (MMJ), mientras que 18 estados permiten un acceso limitado a los productos MMJ. Los estados de acceso limitado permiten productos bajos (o nulos) en tetrahidrocannabinol (THC) y altos en cannabidiol (CBD) para tratar afecciones específicas como la epilepsia no controlada. Aunque los productos MMJ se derivan de las mismas especies de plantas que el MJ recreativo, a menudo se seleccionan por sus componentes y proporciones de cannabinoides únicos, que no suelen ser buscados por los usuarios recreativos, lo que puede afectar los resultados neurocognitivos. Hasta la fecha, pocos estudios han investigado el impacto potencial del uso de MMJ en el rendimiento cognitivo, a pesar de una asociación bien documentada entre el uso de marihuana recreativa (MJ) y la disfunción ejecutiva. El estudio actual evaluó el impacto de 3 meses de tratamiento con MMJ en la función ejecutiva, explorar si los pacientes con MMJ experimentarían una mejora en el funcionamiento cognitivo, quizás relacionada con el alivio de los síntomas primarios. Como parte de un estudio longitudinal más amplio, 24 pacientes certificados para el uso de MMJ completaron evaluaciones de la función ejecutiva inicial y 11 de ellos hasta ahora han regresado para su primera visita de seguimiento 3 meses después de iniciar el tratamiento. Los resultados sugieren que, en general, los pacientes con MMJ experimentaron alguna mejora en las medidas de funcionamiento ejecutivo, incluida la prueba Stroop Color Word Test y Trail Making Test, que se refleja principalmente en una mayor velocidad para completar tareas sin pérdida de precisión. En los cuestionarios de autoinforme, los pacientes también indicaron mejoras moderadas en el estado clínico, incluida la reducción de la alteración del sueño, la disminución de los síntomas de depresión, la impulsividad atenuada, y cambios positivos en algunos aspectos de la calidad de vida. Además, los pacientes informaron una disminución notable en el uso de agentes farmacéuticos convencionales desde el inicio, y el uso de opiáceos disminuyó más del 42%. Si bien son intrigantes, estos hallazgos son preliminares y merecen una mayor investigación en puntos de tiempo adicionales y en tamaños de muestra más grandes. Dada la probabilidad de un mayor uso de MMJ en todo el país, es imperativo determinar el impacto potencial del tratamiento a corto y largo plazo sobre el rendimiento cognitivo, así como la eficacia del tratamiento de MMJ en sí. Estos hallazgos son preliminares y merecen una mayor investigación en puntos de tiempo adicionales y en tamaños de muestra más grandes. Dada la probabilidad de un mayor uso de MMJ en todo el país, es imperativo determinar el impacto potencial del tratamiento a corto y largo plazo sobre el rendimiento cognitivo, así como la eficacia del tratamiento de MMJ en sí. Estos hallazgos son preliminares y merecen una mayor investigación en puntos de tiempo adicionales y en tamaños de muestra más grandes. Dada la probabilidad de un mayor uso de MMJ en todo el país, es imperativo determinar el impacto potencial del tratamiento a corto y largo plazo sobre el rendimiento cognitivo, así como la eficacia del tratamiento de MMJ en sí.
Introducción
Durante las últimas décadas, aunque los usuarios de marihuana (MJ) en los EE. UU. Han buscado históricamente a MJ con fines recreativos, un número creciente está explorando MJ con fines médicos. De hecho, se estima que más de 1.2 millones de consumidores médicos de MJ (MMJ) están registrados actualmente en los EE. UU. (Procon.org1 ). Según Procon.org, aunque la mayoría de los estados tienen registro MMJ obligatorio (CO, MA), otros estados tienen registro voluntario (por ejemplo, CA, ME) o no requieren registro (WA). Si bien el número de consumidores actuales de MMJ en EE. UU. Es solo una estimación, es probable que el número de pacientes certificados continúe creciendo a medida que el público se vuelve cada vez más consciente y abierto a los posibles efectos terapéuticos de MMJ. La marihuana legal se considera el mercado de más rápido crecimiento en los Estados Unidos, con un valor estimado actual de$6.7 mil millones, que podría llegar a 21.8 mil millones en 2020 ( ArcView Market Research, 2016). En 1996, California se convirtió en el primer estado en legalizar completamente la MMJ y desde entonces, otros 24 estados y el Distrito de Columbia han seguido el ejemplo con la legalización total con fines médicos, mientras que otros 18 estados tienen leyes limitadas de MMJ, que permiten solo el uso de productos que contienen un cannabinoide no psicoactivo específico (cannabidiol [CBD]). Cuatro estados y el Distrito de Columbia también han aprobado el uso recreativo de MJ, con varios estados adicionales pendientes de legislación. Encuestas nacionales recientes ( Center for Behavioral Health Statistics and Quality, 2015 ; Johnston et al., 2015 ) informan que MJ mantiene su estatus como la droga ilícita más consumida con fines recreativos en el mundo; casi 22,2 millones de estadounidenses informan haberlos consumido durante el último mes (Centro de Estadísticas y Calidad de la Salud del Comportamiento, 2015). Además, aunque más de un millón de estadounidenses son pacientes de MMJ registrados, esta estimación no incluye el número desconocido de consumidores que actualmente toman productos derivados del cáñamo, comercializados como compuestos con alto contenido de CBD (tinturas, aceites, tópicos), que están ampliamente disponibles en varios proveedores que no requieren la certificación MMJ. A pesar de los rápidos cambios en la política, muchos legisladores, consumidores, médicos y el público en general siguen desinformados sobre MJ. Aunque se utilizó durante siglos como medicina por diversas culturas en todo el mundo, en los EE. UU., MMJ se convirtió en parte de la medicina convencional en 1850, cuando se agregó a la Farmacopea de EE. UU. Los médicos prescribieron el uso de MJ en general para una variedad de indicaciones que incluyen (pero no se limitan a) dolor, emesis, migraña, insomnio, epilepsia y abstinencia de opio ( Birch, 1889; Potter, 1917 ; Grinspoon y Bakalar, 1997 ; Booth, 2003 ) y estuvo ampliamente disponible hasta 1937, cuando la ley de impuestos a la marihuana criminalizó el uso de la sustancia. A medida que crecían los sentimientos anti-MJ en todo el país, se eliminó de la farmacopea en 1942 y en 1970, la aprobación de la Ley de Sustancias Controladas (CSA) declaró al MJ como una sustancia de la Lista I y se prohibió el cultivo, posesión y distribución de MJ. . Según la Administración de Control de Drogas (DEA), las drogas de la Lista I son aquellas «sin uso médico actualmente aceptado, sin un perfil de seguridad demostrado y con un alto potencial de abuso … [son] las drogas más peligrosas de todas las dependencia psicológica o física ”(dea.gov2 ; Ley de Prevención y Control Integral del Abuso de Drogas de 19703 ). Esta clasificación considera que MJ es más peligroso que otras sustancias, incluidas la cocaína, la metanfetamina y las drogas a base de opiáceos, que, irónicamente, son responsables de aproximadamente 30.000 muertes por año ( Centros para el Control y la Prevención de Enfermedades, 2015 ). De hecho, las sobredosis de opioides ahora se consideran una epidemia nacional; la tasa de muertes por sobredosis de opioides, incluidas las relacionadas tanto con analgésicos recetados como con heroína, casi se ha cuadriplicado desde 1999 ( Centros para el Control y la Prevención de Enfermedades, 2015). Dada su clasificación de Anexo I, los estudios de investigación que exploran los posibles riesgos y beneficios de MMJ se han enfrentado a numerosos obstáculos, lo que ha obligado a las políticas a superar a la ciencia en los últimos años. A medida que el clima nacional se calienta hacia MJ, la investigación avanza lentamente. Sin embargo, queda mucho por explorar antes de que la brecha entre ciencia y política pueda comenzar a cerrarse.
Un creciente cuerpo de evidencia sugiere que el uso recreativo de MJ tiene un impacto adverso en el cerebro, particularmente durante los períodos críticos del desarrollo neurológico, incluida la adolescencia (para revisión: Crean et al., 2011 ; Jacobus y Tapert, 2014 ; Lisdahl et al., 2014 ). Numerosos estudios han demostrado que los usuarios de MJ, en particular aquellos que inician su uso durante la adolescencia, presentan déficits en múltiples dominios cognitivos. Por ejemplo, los usuarios de MJ que inician su uso durante la adolescencia presentan déficits de atención ( Ehrenreich et al., 1999 ; Cousijn et al., 2013 ; Becker et al., 2014 ) y velocidad de procesamiento ( Fried et al., 2005 ; Medina et al. ., 2007 ;Lisdahl y Price, 2012 ; Jacobus et al., 2015 ). Además, se han observado puntuaciones más bajas en las medidas de CI ( Pope et al., 2003 ; Meier et al., 2012 ; Crane et al., 2015 ) entre los usuarios adolescentes de MJ, aunque trabajos recientes han cuestionado este hallazgo ( Jackson et al. , 2016 ; Mokrysz et al., 2016 ), y varios estudios han informado de una memoria verbal más pobre entre los fumadores MJ adolescentes y adultos ( Tait et al., 2011 ; Auer et al., 2016 ; Shuster et al., 2016 ). Los datos también sugieren que el uso de MJ en adolescentes está fuertemente asociado con un funcionamiento ejecutivo deficiente ( Fontes et al., 2011 ;Solowij et al., 2012 ; Crane y col., 2013 ; Dougherty y col., 2013 ; Tamm y col., 2013 ; Becker y col., 2014 ; Hanson y col., 2014 ; Winward et al., 2014 ; Jacobus et al., 2015 ; Sagar et al., 2015 ) incluso cuando no se observan déficits en otros dominios ( Gruber et al., 2012a ).
Por el contrario, aunque la investigación está en su infancia, dado lo que se sabe actualmente sobre MJ, es posible que el uso de MMJ no tenga las mismas consecuencias neurocognitivas que se han observado en usuarios recreativos. Aunque el MJ recreativo y médico se deriva de la misma especie de planta, existen diferencias inherentes que existen entre los dos. Dado que los consumidores recreativos buscan con mayor frecuencia un estado que altere el estado de ánimo, a menudo «eufórico» o «suave», utilizan principalmente productos con cantidades considerables de THC, el principal ingrediente psicoactivo de MJ ( Wachtel et al., 2002 ; Zeiger et al., 2010). Durante las últimas dos décadas, la potencia de la marihuana recreativa ha aumentado significativamente de aproximadamente un 4 a un 12% entre 1995 y 2014 en respuesta a la demanda de los consumidores ( ElSohly et al., 2016 ). Por el contrario, los usuarios de MMJ inician principalmente el uso de MMJ como un medio para aliviar los síntomas ( Nunberg et al., 2013 ) y, como tales, es probable que busquen productos por su potencial terapéutico en lugar de experimentar los efectos psicoactivos. Por lo tanto, pueden usar los productos de manera diferente y comprar productos con una composición química marcadamente diferente a la de los productos recreativos más comunes. Estos productos MMJ a menudo (pero no siempre) tienen un alto contenido de otros cannabinoides, como el cannabidiol (CBD), que ha sido promocionado por su potencial terapéutico, y que no lo es.psicoactivo. El CBD se ha vuelto más conocido en los últimos años por su potencial para tratar a personas con trastornos convulsivos intratables, específicamente niños con síndrome de Dravet o síndrome de Lennox Gastaux, y los datos preliminares de informes anecdóticos y ensayos clínicos recientes son prometedores. En un ensayo abierto reciente en pacientes de 1 a 30 años de edad con epilepsia severa, intratable, de inicio en la infancia y resistente al tratamiento, Devinsky et al. (2016) informaron que la frecuencia mensual promedio de convulsiones motoras disminuyó de 30 por mes al inicio a 15,8 por mes durante el período de tratamiento en pacientes tratados con Epidolex, un compuesto de CBD purificado al 98% creado por GW Pharma. El CBD también ha demostrado ser prometedor en el tratamiento de otras afecciones, incluido el dolor crónico y la esclerosis múltiple ( Giacoppo et al., 2015) y la enfermedad de Huntington ( Consroe et al., 1991 ), así como afecciones psiquiátricas y de salud conductual que incluyen ansiedad (para revisión: Blessing et al., 2015 ) y psicosis ( Zuardi et al., 2009 ; Leweke et al., 2012 ). Curiosamente, algunos trabajos sugieren que el CBD puede tener un perfil farmacológico similar al de los medicamentos antipsicóticos ( Zuardi et al., 2012). Además del CBD, una serie de otros cannabinoides, muchos de los cuales no son psicoactivos, también suelen estar presentes en los productos MMJ y se están volviendo cada vez más populares. Otros fitocannabinoides, incluidos cannabigerol (CBG), cannabinol (CBN), cannabicromeno (CBC), ácido tetrahidrocannabinólico (THCA) y tetrahidrocannabidivarina (THCV), han mostrado potencial terapéutico y también pueden reducir algunos de los efectos indeseables asociados con el THC. Por ejemplo, el cannabicromeno (CBC), otro cannabinoide abundante, tiene efectos antiinflamatorios ( Izzo et al., 2012 ) y recientemente se ha demostrado que aumenta la viabilidad de las células madre progenitoras neurales adultas (CPNM), esenciales para la plasticidad cerebral y sugerentes. de la neurogénesis ( Shinjyo y Di Marzo, 2013). Además, el cannabigerol (CBG) inhibe la captación de GABA, tiene propiedades antiinflamatorias y también se ha promocionado como neurogénico ( Borelli et al., 2013 ; Valdeolivas et al., 2015 ), mientras que se ha demostrado que la tetrahidrocannabidivarina (THCV) inhiben algunos de los efectos cognitivos y fisiológicos negativos del THC y pueden ser neuroprotectores ( Englund et al., 2016 ).
A pesar de que la mayoría de los estados tienen leyes MMJ y más de un millón de pacientes registrados, ningún estudio hasta la fecha ha utilizado un modelo de diseño previo y posterior para examinar el impacto específico de MMJ en el rendimiento cognitivo como una variable de resultado primaria. Como se señaló anteriormente, los déficits cognitivos se demuestran en usuarios crónicos, intensos y recreativos de MJ que comienzan a usar MJ durante la adolescencia (para revisión: Crean et al., 2011 ; Jacobus y Tapert, 2014 ; Lisdahl et al., 2014 ), y aunque algunos Se han iniciado ensayos clínicos de MMJ (particularmente CBD) en niños para la epilepsia resistente al tratamiento ( Devinsky et al., 2016), la mayoría de los que utilizan los productos MMJ son adultos y están más allá del período más crítico de vulnerabilidad del desarrollo neurológico. Además, es probable que si se abordan los síntomas físicos o psicológicos mediante el uso de MMJ, la función cognitiva pueda mejorar. Por ejemplo, los estudios han informado que la ansiedad a menudo interfiere tanto con la atención como con la función ejecutiva (p. Ej., Vytal et al., 2013 ); si los productos MMJ actúan como ansiolíticos para al menos algunos pacientes, como se informó, esto puede resultar en una mejor concentración y un mejor desempeño cognitivo. También se ha observado que el dolor crónico afecta el rendimiento cognitivo, en particular las tareas que requieren la función de atención y ejecutiva (para una revisión, ver Moriarty et al., 2011). En consecuencia, si los pacientes experimentan una reducción de los síntomas relacionados con el dolor como resultado del tratamiento con MMJ, es probable que el rendimiento cognitivo mejore en relación con una evaluación previa al tratamiento.
Para evaluar el impacto del uso de MMJ en la función cognitiva y determinar la eficacia de MMJ en una muestra amplia de pacientes con MMJ, diseñamos un estudio longitudinal que evalúa a los pacientes con MMJ al inicio y después de 3, 6 y 12 meses de tratamiento con MMJ. Es importante destacar que las mediciones iniciales se tomaron antes del inicio del tratamiento con MMJ para obtener una evaluación de «MJ sin experiencia». Dadas las diferencias entre el uso de MMJ y el uso recreativo de MJ y el potencial informado para el alivio de los síntomas en los usuarios de MMJ, planteamos la hipótesis de que los pacientes de MMJ demostrarían un rendimiento cognitivo mejorado en tareas de funcionamiento ejecutivo, así como un mejor estado clínico y calidad de vida después del tratamiento con MMJ. Este estudio está actualmente en curso, y en este documento,
Materiales y métodos
Participantes
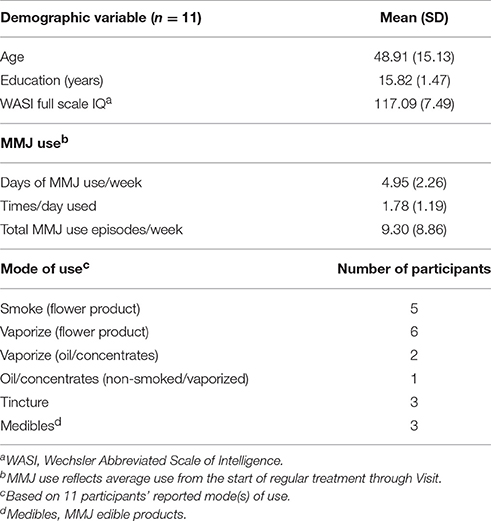
Hasta la fecha, 32 participantes completaron los procedimientos de detección, de los cuales 24 usuarios de MMJ se inscribieron con éxito en el estudio actual. Los datos de las visitas de control iniciales y de 3 meses de 11 pacientes (visita 2) estaban disponibles para un análisis preliminar. Para calificar para la entrada al estudio, los participantes deben ser ingenuos de MJ o si tienen un historial de uso de MJ, deben informar la abstinencia de MJ durante 10 o más años en un esfuerzo por garantizar que la exposición reciente a MJ no afecte los resultados. El estado de MJ del autoinforme se confirmó con un análisis de orina. Los participantes también deben tener una certificación válida para MMJ y pueden informar que buscan tratamiento MMJ para una variedad de indicaciones; la muestra actual ( n = 11) informó la certificación MMJ para ansiedad ( n = 5), depresión ( n= 3), dolor crónico ( n = 7), sueño ( n = 5) y otras condiciones ( n = 6). En particular, 9 de 11 participantes informaron haber buscado tratamiento con MMJ para dos o más afecciones o síntomas.
Diseño del estudio
Antes de la participación, se explicaron detalladamente los procedimientos del estudio y se pidió a todos los participantes que leyeran y firmaran un formulario de consentimiento informado. Este documento describe los procedimientos, riesgos, beneficios y naturaleza voluntaria del estudio. Todos los procedimientos del estudio fueron aprobados por la Junta de Revisión Institucional de Partners (IRB).
Antes de iniciar el tratamiento con MMJ, todos los participantes inscritos completaron una batería neurocognitiva, así como medidas de estado clínico, calidad de vida, sueño y evaluaciones de salud general. Además, los pacientes elegibles completaron sesiones de neuroimagen (es decir, imágenes de resonancia magnética funcional y estructural), que se informarán en publicaciones posteriores. Después de 3 meses de tratamiento regular con MMJ, los participantes regresaron para una visita de control (Visita 2) y repitieron todas las medidas del estudio. Además, una vez que los pacientes comenzaron un régimen de uso regular de MMJ, fueron contactados por teléfono para completar visitas de control mensuales, que evaluaron el tipo, la frecuencia y la magnitud del uso de MMJ mediante un procedimiento de seguimiento de línea de tiempo modificado (TLFB; Sobell et al. , 1998) y otras consultas. Durante las llamadas de registro, se pidió a los pacientes que proporcionaran información cualitativa sobre el tipo de producto y la cepa de los productos MMJ utilizados, así como el modo de uso (es decir, porros, vaporizador, tintura, comestibles, etc.) e información cuantitativa con respecto a la frecuencia (episodios de MMJ uso / semana) y magnitud (dosis / semana) de uso. Estos datos fueron revisados, aclarados y corroborados en persona durante la Visita 2. Cada participante también proporcionó una muestra de su producto MMJ de uso más frecuente, que fue analizado por un laboratorio externo (ProVerde Laboratories, Inc.) para obtener cannabinoides perfil de constituyentes para cada producto, proporcionando información sobre los niveles de THC y CBD, así como una serie de otros cannabinoides.
Evaluaciones cognitivas y clínicas
Todos los sujetos completaron la Escala abreviada de inteligencia de Wechsler (WASI; Wechsler, 1999 ), que proporciona una estimación del funcionamiento cognitivo general, para asegurar un coeficiente intelectual estimado de 75 o más. Como parte de una batería neurocognitiva más grande, cada individuo completó varias medidas de funcionamiento ejecutivo, incluida la prueba Stroop Color Word, la prueba Trail Making, la prueba de clasificación de tarjetas de Wisconsin (WCST) y la subprueba de secuenciación de letras y números de la inteligencia adulta de Wechsler Escala (WAIS). Prueba de palabras de color de Stroop ( MacLeod, 1991) evalúa la capacidad de inhibir una respuesta automática sobreaprendida. Mientras que la primera condición de la tarea (denominación de colores) evalúa las habilidades de denominación rápida, la segunda condición (lectura de palabras) requiere que el individuo lea palabras impresas en tinta negra que también sirve como base para la tercera tarea (interferencia) donde deben inhibir la tendencia natural a leer las palabras en voz alta y, en cambio, debe nombrar el color de la tinta en la que se imprimen las palabras. Durante la condición de interferencia, cada palabra se imprime en un color incongruente con la palabra real (es decir, rojo impreso en verde o azul impreso en rojo). La prueba de creación de senderos ( Lezak et al., 2004) se compone de dos condiciones cronometradas en las que los participantes deben conectar una serie de puntos. Trails A mide la función psicomotora, la exploración visual y la atención pidiendo a los participantes que conecten puntos en orden numérico. Los senderos B incorporan demandas de conjuntos alternos, que requieren que los participantes alternen entre números y letras (por ejemplo, 1, A, 2, B, etc.), para medir la flexibilidad cognitiva y la función ejecutiva. El WCST ( Berg, 1948 ; Lezak et al., 2004) es una medida sólida del funcionamiento ejecutivo, que también evalúa la flexibilidad cognitiva y el cambio de set. Todos los participantes completaron una administración computarizada de la tarea en la que deben hacer coincidir las tarjetas según las reglas de clasificación y ajustarse a las reglas de clasificación cambiantes basándose únicamente en la retroalimentación sobre si cada coincidencia es correcta o incorrecta. Finalmente, durante la tarea de secuenciación de letras y números ( Wechsler, 1997), a los participantes se les leen cadenas de números y letras cada vez más largas y se les pide que las repitan, primero citando los números en orden y luego las letras en orden alfabético. El desempeño en esta tarea se correlaciona con la función ejecutiva y las capacidades de la memoria de trabajo. Los sujetos completaron todas las tareas al inicio del estudio y en la visita de seguimiento a los 3 meses, con la excepción del WASI, que se administró solo al inicio del estudio para obtener una estimación del coeficiente intelectual.
Para determinar si los pacientes experimentaron algún cambio en los síntomas clínicos o en las medidas relacionadas con la salud que pudieran afectar el rendimiento cognitivo, cada participante completó una batería de evaluaciones del estado clínico, incluido el Perfil de los estados de ánimo (POMS), el Inventario de depresión de Beck (BDI) , El Inventario de Ansiedad de Beck (BAI) y la Escala de Impulsividad de Barratt (BIS), así como cuestionarios de calidad de vida y salud general, incluido el Índice de Calidad del Sueño de Pittsburgh (PSQI) y la Encuesta de Salud Short-Form 36 (SF-36). El POMS ( Pollock et al., 1979 ) mide el estado de ánimo autopercibido y genera subpuntuaciones para sentimientos de vigor, confusión, tensión, ira, depresión y fatiga, que se combinan para generar una medida general de alteración total del estado de ánimo (TMD). El BDI ( Beck et al., 1961) y BAI ( Beck y Steer, 1990 ) son breves medidas de autoinforme que evalúan directamente los síntomas de depresión y ansiedad. El BIS ( Patton et al., 1995 ) evalúa la impulsividad autoinformada en tres dominios discretos (Atención, Motor y No Planificación), que juntos proporcionan una puntuación compuesta general. El PSQI ( Buysse et al., 1989 ) proporciona una medida de la calidad del sueño durante el último mes. El SF-36 ( Ware y Sherbourne, 1992) El cuestionario es una encuesta de salud de formato corto y multipropósito que produce un perfil de ocho escalas de puntajes de salud funcional y bienestar para los siguientes dominios: funcionamiento físico, limitaciones del rol físico, limitaciones del rol emocional, energía / fatiga, bienestar emocional -ser, funcionamiento social, dolor y salud general.
Además, también se realizó un seguimiento del uso de medicamentos farmacéuticos convencionales por parte de los pacientes para determinar si el uso de MMJ podría estar relacionado con cambios en el uso de otros medicamentos. Al inicio del estudio y durante la Visita 2, los participantes proporcionaron una lista de los medicamentos utilizados al menos una vez a la semana. Luego, estos medicamentos se codificaron en diferentes clases, incluidos opiáceos, antidepresivos, estabilizadores del estado de ánimo, benzodiazepinas, sedantes y relajantes musculares. Se calcularon los datos de cambio porcentual basados en el número de dosis tomadas por semana para el uso de medicamentos desde el inicio hasta la Visita 2.
Análisis estadístico
Se calcularon estadísticas descriptivas (p. Ej., Media y desviación estándar) para las variables demográficas y de uso de MMJ. Se utilizaron pruebas t pareadas para evaluar los cambios intraindividuales desde el inicio hasta la visita 2. Dadas nuestras hipótesis de que el tratamiento con MMJ se asociaría con un mejor rendimiento cognitivo, estado clínico y calificaciones de salud general, se utilizaron pruebas t de una cola en todo momento.
Resultados
Demografía
Como se informa en la Tabla 1, los participantes (6 hombres, 5 mujeres) inscritos en el estudio actual tenían entre 32 y 74 años, con una edad promedio de 48,91 años. En general, los participantes tenían una buena educación, todos habían obtenido al menos un diploma de escuela secundaria y tenían al menos una inteligencia promedio, como se indica en el WASI. Todos informaron haber usado MMJ al menos semanalmente desde el inicio del tratamiento regular con MMJ (1 a 7 días por semana; 4,95 días en promedio). La mitad de la muestra informó el uso típico de productos MMJ más de una vez al día; los pacientes informaron que usaron MMJ 1,78 veces al día en promedio, lo que resultó en un promedio semanal total de 9,30 episodios por semana. Con respecto al tipo de producto y modo de uso, la mayoría de los participantes (8 de 11) informaron haber usado productos florales en alguna forma (ahumados o vaporizados). Uso informado de concentrados y aceites (3 de 11) y “medibles” (productos comestibles MMJ; 3 de 11) por los participantes fue menos frecuente. Otros modos de administración (es decir, tópicos) no se informaron entre la muestra actual.TABLA 1
Rendimiento cognitivo
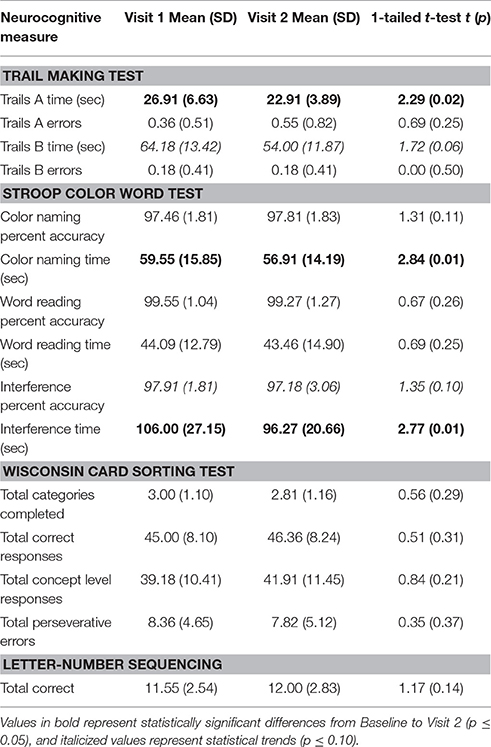
Como se muestra en la Tabla 2 , después de 3 meses de tratamiento con MMJ, los participantes completaron los Trails A significativamente más rápido ( p = 0.02) y también tendieron a completar los Trails B ( p = 0.06) más rápido en relación con la línea de base. Además, esta mejora no fue a expensas de la precisión de la tarea, ya que no se observaron diferencias en el número de errores en las visitas para los Trails A o Trails B. En la prueba Stroop Color Word, los participantes también demostraron tiempos de finalización más rápidos y algunas mejoras en la precisión de las tareas. después de 3 meses de tratamiento. En comparación con la línea de base, el rendimiento en la condición de denominación de color fue significativamente más rápido ( p= 0.01), nuevamente sin disminución en el porcentaje de precisión. El rendimiento prácticamente no cambió en todas las visitas en la subprueba de lectura de palabras, que se utiliza principalmente para preparar a los participantes para la condición de interferencia. Durante la condición de Interferencia, los participantes también demostraron tiempos de finalización más rápidos en relación con la línea de base ( p= 0,01). Aunque no se detectó ninguna mejora en la precisión de la condición de interferencia, los participantes mantuvieron sus altos niveles de rendimiento desde el inicio hasta las visitas de control de los 3 meses. En general, en el WCST, no se observaron cambios en el desempeño para las categorías completadas, respuestas correctas o errores perseverantes, y aunque se observaron algunas mejoras desde la línea de base hasta la Visita 2, estas no alcanzaron significación estadística. En la tarea de secuenciación de números de letras, mientras que el número total de respuestas correctas aumentó ligeramente desde el inicio hasta la visita 2, esta diferencia no alcanzó significación estadística.TABLA 2
Calificaciones clínicas y uso de medicamentos farmacéuticos
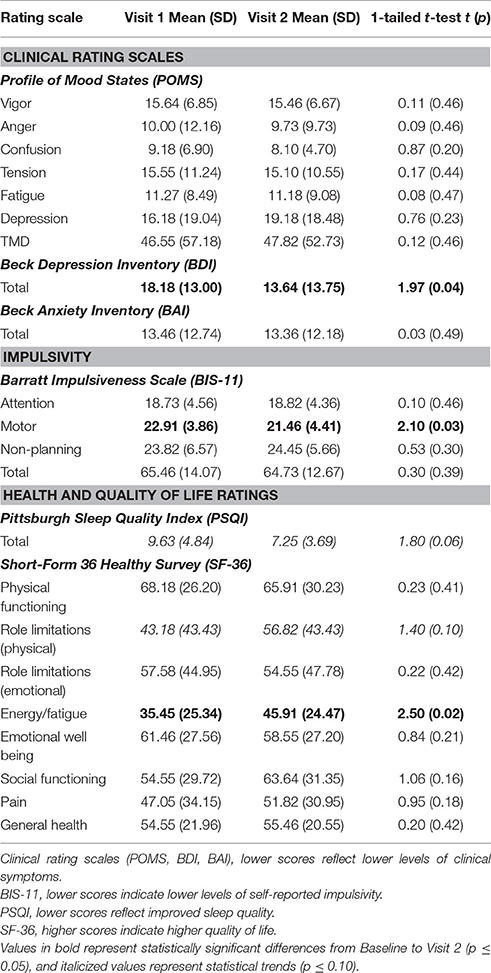
Como se indica en la Tabla 3 , varias medidas discretas del estado clínico y la salud general mejoraron en relación con la línea de base. Los participantes informaron niveles significativamente más bajos de depresión en el BDI (18,18 frente a 13,64, p = 0,04), así como una tendencia a un nivel más bajo de alteración del sueño (que refleja una mejora del sueño) en el PSQI (9,63 frente a 7,25, p = 0,06). Además, los participantes informaron un grado moderado de disminución de la impulsividad en el BIS (subpuntuación motora: 22,91 frente a 21,46, p = 0,03). En el SF-36, los participantes también informaron en general una mejor calidad de vida, incluidas mejoras significativas en una escala que mide Energía / Fatiga (35,45 frente a 45,91, p.= 0,02), así como una tendencia a menos limitaciones de funciones debido a la salud física (43,18 frente a 56,82, p = 0,07), que refleja la frecuencia con la que los pacientes «reducen la cantidad de tiempo que [ellos] dedican al trabajo u otras actividades», » lograron menos de lo que les gustaría ”,“ se vieron limitados en el tipo de trabajo u otras actividades ”o“ tuvieron dificultades para realizar el trabajo u otras actividades ”como resultado de su salud física.TABLA 3
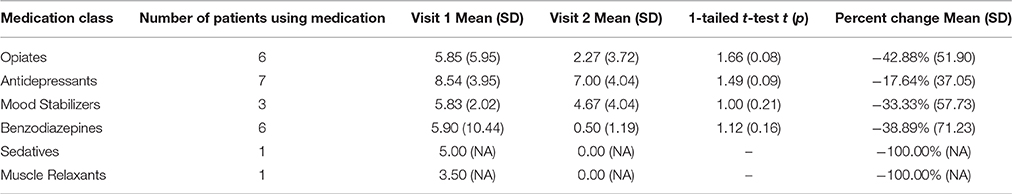
Después de 3 meses de tratamiento con MMJ, los participantes también informaron reducciones en el uso de productos farmacéuticos convencionales. Como se muestra en la Tabla 4 , los datos de cambio porcentual [(Visita 2-Visita 1) / Visita 1] revelaron una disminución notable en el uso semanal en todas las clases de medicamentos, incluidas reducciones en el uso de opiáceos (-42,88%), antidepresivos (-17,64%) ), estabilizadores del estado de ánimo (-33,33%) y benzodiazepinas (-38,89%). Curiosamente, las pruebas t indicaron tendencias de reducciones significativas en el uso de opiáceos (5,85 frente a 2,27, p = 0,08) y antidepresivos (8,54 frente a 7,00, p = 0,09). Aunque el uso de sedantes (−100,00%) y relajantes musculares (−100,00%) se redujo notablemente, estos datos solo se basaron en un participante para cada una de estas clases de medicamentos.TABLA 4
Discusión
A pesar de los rápidos cambios en la ley, muchos legisladores, consumidores, médicos y el público en general siguen desinformados sobre MJ. Si bien un conjunto de evidencia ha demostrado alteraciones en la estructura y función del cerebro secundarias al uso recreativo de MJ, particularmente relacionadas con el uso durante períodos de desarrollo vulnerables como la adolescencia (para revisión: Crean et al., 2011 ; Jacobus y Tapert, 2014 ; Lisdahl et al. ., 2014 ), quedan sin respuesta preguntas críticas sobre el impacto del uso de MMJ. Hasta donde sabemos, el estudio piloto actual marca la primera investigación para examinar específicamente el rendimiento cognitivo y las medidas relacionadas en pacientes con MMJ antes del inicio del tratamiento.relativo al rendimiento después del uso regular de MMJ. Los resultados preliminares de esta primera fase del estudio sugieren que después de 3 meses de tratamiento con MMJ, los participantes experimentaron cierto grado de mejora en las tareas del funcionamiento ejecutivo. Además, no se observaron disminuciones significativas en el desempeño en ninguna medida de la función ejecutiva realizada por los participantes.
Además, los resultados del estudio actual sugirieron alguna mejora en las medidas autoinformadas del estado clínico y la salud general. Los participantes de MMJ informaron una mejora significativa en las medidas de depresión e impulsividad. Las calificaciones de los participantes también indicaron alguna mejora en la calidad del sueño, que probablemente esté relacionada con las calificaciones de un aumento significativo de energía y una disminución de la fatiga en las medidas de autoinforme que evalúan la calidad de vida. Los resultados del estudio proporcionan más evidencia de mejoras en los síntomas médicos y clínicos secundarios al uso de MMJ, en consonancia con otros informes recientes que también han demostrado diversos grados de eficacia de las terapias basadas en cannabinoides ( Boychuk et al., 2015 ; Deshpande et al., 2015 ; Press et al., 2015 ;Whiting et al., 2015 ; Devinsky y col., 2016 ; Haroutounian et al., 2016 ; Wilkie et al., 2016 ).
En un estudio de encuesta de residentes de California, Ryan-Ibarra et al. (2015) encontraron recientemente que del 5% de California que informó haber usado MMJ alguna vez, el 92% informó que MMJ ayudó a tratar una afección médica grave, siendo el dolor la indicación de uso más comúnmente informada. En particular, las mejoras observadas en el estudio actual se produjeron de forma concomitante con una reducción en el uso informado de productos farmacéuticos (en particular opiáceos y antidepresivos), que se utilizan para tratar muchos síntomas para los que los pacientes de este estudio iniciaron el uso de MMJ. En un estudio europeo reciente diseñado para evaluar el impacto de MMJ en el dolor crónico, Haroutounian et al. (2016)también informaron reducciones en el uso de fármacos convencionales entre los pacientes del estudio, específicamente con respecto al uso de opioides. De manera similar, un estudio que examinó los registros médicos de 1655 pacientes que buscaban una certificación médica en múltiples clínicas de evaluación de MMJ en California encontró que la mitad de los solicitantes informaron que usaban MJ como sustituto de un medicamento recetado ( Nunberg et al., 2013 ). Dada la actual crisis de opiáceos, es fundamental examinar el papel potencial de los cannabinoides, ya que muchos pacientes no obtienen un alivio total de los síntomas de las terapias convencionales basadas en opiáceos y a menudo se quejan de la gran cantidad de efectos secundarios asociados ( Ballantyne y Shin, 2008 ; Rosenblum et al., 2008). Además, es importante considerar un estudio reciente que encontró que los usuarios de MJ informaron un mayor alivio del dolor cuando se usaba MJ en combinación con opioides farmacéuticos que cuando los opioides se usaban solos ( Degenhardt et al., 2015 ).
Se pueden considerar varias hipótesis para las mejoras observadas en la investigación piloto actual. Primero, como se postuló, los participantes experimentaron cierta mejoría de los síntomas clínicos. Esta reducción de la sintomatología, en combinación con mejoras informadas en otras medidas (mejor sueño, menos impulsividad), puede resultar en las mejoras observadas en el funcionamiento cognitivo. Como se señaló anteriormente, los síntomas que se informan comúnmente en pacientes con MMJ, incluidos la ansiedad y el dolor, se han asociado con un rendimiento cognitivo reducido ( Moriarty et al., 2011 ; Vytal et al., 2013 ). Por tanto, la mejora de los síntomas puede resultar en una mejora del rendimiento cognitivo. Curiosamente, dos estudios previos han observado una asociación positiva entre un historial de uso de MJ y una mejoríarendimiento cognitivo en medidas de velocidad psicomotora, atención, memoria de trabajo, funcionamiento ejecutivo y aprendizaje verbal en pacientes con trastorno bipolar en comparación con pacientes sin antecedentes de consumo de marihuana ( Ringen et al., 2010 ; Braga et al., 2012 ). Se necesitan más investigaciones, dado el número de pacientes que buscan tratamiento con MMJ por síntomas que se sabe que interfieren con la función cognitiva.
También es posible que los propios productos MMJ protejan contra los déficits de la función ejecutiva que se han informado ampliamente en los usuarios recreativos de MJ (para una revisión, ver Crean et al., 2011 ). Aunque los resultados del estudio actual parecen estar en marcado contraste con los de algunos estudios MJ recreativos, la respuesta puede estar en las diferencias inherentes entre los productos MMJ y recreativos MJ y las diferencias entre los dos grupos de consumidores. Si bien la potencia del THC está aumentando y los niveles de CBD han disminuido a niveles apenas perceptibles en las cepas MJ recreativas ( ElSohly et al., 2016 ), algunos productos MMJ contienen cantidades más altas de CBD y otros cannabinoides que pueden mitigar los efectos adversos del THC sobre el rendimiento cognitivo. Aunque la investigación es limitada en esta área,Englund y col. (2013) encontraron que la administración de CBD antes de la administración intravenosa de THC en participantes de control sanos resultó en una mejor memoria episódica en comparación con el placebo. En otro estudio sobre la administración aguda de CBD en usuarios recreativos de MJ que fumaron una vez al mes durante al menos un año, Morgan et al. (2010) informaron que aquellos que fumaban cepas MJ bajas en CBD se desempeñaban peor en una tarea de memoria verbal que aquellos que fumaban cepas MJ altas en CBD. De manera similar, una extensión de ese estudio examinó los niveles de THC y CBD obtenidos a través de muestras de cabello y encontró que niveles más altos de CBD se asociaron con una mejor memoria de reconocimiento en relación con niveles de CBD indetectables ( Morgan et al., 2012 ). Si bien la mayoría de los estudios han investigado el impacto del CBD en la memoria verbal,Borgwardt y col. (2008) utilizaron una tarea Go / No Go, que mide la función inhibidora, para examinar el impacto funcional del CBD en voluntarios sanos. Los resultados de las imágenes funcionales revelaron que mientras que el THC redujo la activación en la circunvolución del cíngulo anterior y frontal inferior derecho, el CBD desactivó la corteza temporal izquierda y la ínsula en relación con el placebo. Los autores concluyeron que el THC puede atenuar la actividad de las regiones del cerebro que median la inhibición de la respuesta, mientras que el CBD altera la función en regiones que no suelen estar implicadas en la inhibición de la respuesta. Bhattacharyya y col. (2010)También encontró que la administración intravenosa de THC y CBD tenía efectos opuestos sobre los patrones de activación cerebral en varias regiones del cerebro durante la finalización de las medidas de memoria, inhibitorias, visuales y afectivas. Tomados en conjunto, estos resultados sugieren además que el THC y el CBD parecen afectar el cerebro de manera muy diferente, con el CBD demostrando potencial para mitigar las consecuencias cognitivas adversas que se han observado ampliamente en los fumadores recreativos de MJ. El estudio actual incluyó a personas que usaban productos con alto contenido de CBD, así como a personas que usaban productos con alto contenido de THC; análisis futuros que incluyen niveles cuantificados de THC, CBD y varios otros cannabinoides de los participantes
Además, es posible que algunas de las consecuencias adversas observadas en los usuarios recreativos de MJ no se hayan observado en el estudio actual, ya que todos los pacientes inscritos se consideran más allá de la edad de vulnerabilidad del desarrollo neurológico. Los estudios longitudinales han demostrado que el cerebro continúa desarrollándose a lo largo de los años veinte ( Giedd et al., 1999 ); sin embargo, todos los participantes incluidos en el análisis actual tenían más de 30 años. Numerosos estudios de investigación han encontrado que los usuarios recreativos de MJ con inicio en la adolescencia experimentan los déficits cognitivos más pronunciados ( Lisdahl et al., 2013 , 2014 ; Jacobus y Tapert, 2014 ), y aquellos con inicio tardío a menudo se desempeñan de manera más similar a los no MJ. fumar sujetos de control sanosGruber y col., 2012a ; Sagar et al., 2015 ). En consecuencia, nuestra muestra adulta de inicio de MJ puede no ser tan vulnerable al impacto negativo de MJ, específicamente productos con alto contenido de THC, como aquellos que usan MJ durante períodos de vulnerabilidad del desarrollo.
Limitaciones y direcciones futuras
Aunque los datos de la investigación actual han generado hallazgos preliminares interesantes, es importante considerar estos resultados a la luz de varias limitaciones. Como estudio piloto, hasta ahora solo hemos investigado el impacto del uso de MMJ en las medidas de funcionamiento ejecutivo. Los estudios futuros deberían explorar dominios cognitivos adicionales. Además, el tamaño de la muestra es intrínsecamente modesto por naturaleza. Sin embargo, se siguen reclutando e inscribiendo sujetos adicionales. Con sujetos adicionales y un mayor poder estadístico, los análisis futuros pueden emplear modelos de regresión para determinar si los patrones de uso de MMJ, el tipo de producto, las proporciones de constituyentes, las indicaciones de uso u otros factores adicionales predicen el rendimiento cognitivo, el estado de ánimo o la mejora de los síntomas. Por ejemplo, mientras que varios pacientes fuman o vaporizan productos de flores MJ, varios también usaban tinturas, aceite o comestibles de manera constante. Con el fin de informar la política y las pautas de uso, se necesita investigación para determinar si ciertos modos de uso tienen un impacto diferencial en la cognición, la calidad de vida y los síntomas clínicos y médicos. Del mismo modo, la información recopilada de los análisis de laboratorio, que proporcionan información sobre los perfiles de cannabinoides de cada producto, puede proporcionar datos críticos sobre el impacto de los componentes individuales y, finalmente, el impacto de proporciones específicas (es decir, THC: CBD) en las medidas cognitivas y clínicas. En el estudio observacional actual, los pacientes son libres de usar los productos de su elección y, a menudo, «prueban» una variedad de productos para determinar qué funciona mejor para ellos, especialmente en las primeras etapas del tratamiento, lo que probablemente aumenta la validez ecológica. Además, Con solo un puñado de dispensarios disponibles para aquellos dentro del área metropolitana de Boston, los pacientes en el estudio actual han informado estar limitados a los productos que están disponibles actualmente y, a veces, se ven obligados a cambiar de producto debido a cambios en la disponibilidad. Sin regulaciones estatales o federales para mantener el control de calidad, los productos también pueden variar en potencia y composición con el tiempo o entre dispensarios. Con muestras más grandes, nuestro objetivo es explorar estas preguntas de manera más completa. Por ejemplo, planeamos realizar análisis que examinen la posibilidad de que los productos con alto contenido de CBD puedan haber contribuido a los cambios positivos en los resultados clínicos y quizás hayan mitigado algunas de las consecuencias cognitivas adversas que históricamente se han observado en los usuarios recreativos de MJ.
Además, aunque este estudio empleó un diseño de tratamiento previo y posterior para evaluar los cambios intraindividuales, dada su naturaleza observacional, no se pudo utilizar un grupo de individuos que tomaban placebo o recibían un tratamiento «simulado»; los participantes en esta investigación adquieren productos MMJ a su propia discreción de los dispensarios locales y / o cuidadores y, por lo tanto, no es posible un brazo de placebo. En el trabajo posterior, planeamos utilizar ensayos clínicos con procedimientos doble ciego más sólidos; sin embargo, hasta ahora, la clasificación de la Lista I de MJ ha obstaculizado los esfuerzos para realizar este tipo de ensayos clínicos.
Dado que el diseño del estudio actual requiere que los participantes completen administraciones repetidas de evaluación neurocognitiva, no podemos excluir la posibilidad de que los efectos de la práctica afecten los resultados del estudio a pesar de los intentos de minimizar este posible factor de confusión. Si bien las tareas completadas en la visita inicial serían familiares para los sujetos en la Visita 2, es poco probable que los efectos de la práctica persistan después de un intervalo de 3 meses entre las visitas del estudio. Por ejemplo, un estudio de los efectos de la práctica en las pruebas neuropsicológicas en serie no encontró efectos en las tareas de secuenciación de números de letras y creación de pistas, incluso con la administración semanal ( Beglinger et al., 2005).) —Un programa de pruebas mucho más frecuente que el utilizado en el estudio actual. Los estudios que señalan los efectos de la práctica en la prueba de Stroop han utilizado típicamente una administración diaria a semanal, también un intervalo significativamente más frecuente que 3 meses ( Gul y Humphreys, 2015 ). Además, utilizamos versiones alternativas de medidas de prueba en la Visita 2, lo que reduce aún más el riesgo de efectos de la práctica. Para tareas complejas como el WCST, donde no existe una versión alternativa, se utilizó una versión computarizada de la tarea, que termina al completar un número específico de categorías correctas sin ninguna aclaración de las reglas, para reducir el potencial aprendizaje de la tarea.
En el pasado, hemos tenido éxito en estudios de usuarios recreativos que utilizan procedimientos TLFB para rastrear el uso de MJ ( Gruber et al., 2012a , b , 2014 ; Sagar et al., 2015 , 2016 ; Dahlgren et al., 2016). Si bien los pacientes de MMJ parecen ser veraces y precisos al proporcionar datos sobre la frecuencia y la magnitud del uso, no se puede confirmar la precisión de sus autoinformes. Sin embargo, para abordar este desafío, los informes de uso durante los registros telefónicos se verificaron y revisaron en la segunda visita en persona de los pacientes. En general, la cuantificación del uso de MJ sigue siendo un desafío en todos los estudios de investigación, ya que, a diferencia de otras sustancias, no se dispone de una medida estándar de uso. Esto es especialmente cierto cuando se consideran productos concentrados, que a menudo contienen altos niveles de THC (es decir, más del 60%) en un volumen o peso muy pequeño. Aunque se recopiló información sobre el uso de MMJ y se informan las principales variables de uso de MMJ (es decir, días usados por semana, tiempos usados por día), los estudios futuros explorarán el impacto de los patrones de uso de MMJ (frecuencia, moda, proporciones de constituyentes, edad de inicio, duración del uso, modo de uso, etc.) y composición del producto MMJ (es decir, THC frente a CBD), análisis que se planifican una vez que se logran tamaños de muestra más grandes. Aún se necesitan ensayos clínicos orientados específicamente a la evaluación de productos MMJ individuales para ayudar a abordar los problemas de las variables de confusión y proporcionar datos adicionales con respecto a la gran cantidad de preguntas, que solo continúan creciendo a medida que aprendemos más sobre MMJ.
Además, también será importante determinar si las mejoras observadas en el estudio actual persisten durante períodos de tiempo más prolongados. Por esta razón, el estudio actual está diseñado para seguir rastreando el rendimiento cognitivo y el estado clínico de los sujetos durante el transcurso de 1 año de tratamiento. Los estudios futuros también deben investigar si las indicaciones clínicas específicas para el uso de MMJ impactan los resultados del estudio. Si bien algunos estudios ya han comenzado a investigar los efectos de los tratamientos basados en cannabinoides para enfermedades o síntomas específicos, como el dolor ( Eisenberg et al., 2014 ; Baron, 2015 ), la esclerosis múltiple ( Flachenecker et al., 2014 ; Patti et al. ., 2016 ) y epilepsia ( Press et al., 2015 ;Devinsky et al., 2016 ), es fundamental evaluar si el uso de MMJ y productos relacionados tienen un impacto diferencial en la cognición dentro de estas poblaciones. Por último, las investigaciones futuras deberían tener como objetivo explorar el mecanismo de mejora observado en el estudio actual. Por ejemplo, dado que los resultados indican principalmente mejoras en los tiempos de finalización de las tareas, se pueden justificar exámenes más centrados de los efectos de la velocidad de procesamiento.
Aunque nuestra investigación ha comenzado a abordar el impacto potencial del tratamiento con MMJ en la cognición, quedan más preguntas que respuestas. Nuestros hallazgos subrayan la necesidad de una investigación y exploración adicionales y ampliadas. Con la nación en medio de una “fiebre verde” ( Silver, 2016 ), es imperativo aclarar los problemas, incluidas las formas en que difieren el uso de MJ recreativo y médico. Además, dados los estudios previos que evalúan el impacto del uso recreativo de MJ en adolescentes o adultos emergentes ( Crean et al., 2011 ; Gruber et al., 2012a , b , 2014 ; Jacobus y Tapert, 2014 ; Lisdahl et al., 2014 ; Sagar et al., 2015 , 2016; Dahlgren et al., 2016 ), será fundamental determinar si se observan las mismas disminuciones en los consumidores adultos que usan MMJ para el alivio de los síntomas a corto o largo plazo. Las preguntas sobre cómo el uso de MMJ afecta la calidad de vida, el sueño, el estado clínico y otras medidas importantes permanecen y son áreas críticas para futuras investigaciones longitudinales.
Dado el hecho de que más de 22 millones de estadounidenses informan sobre el uso actual de MJ recreativo ( Centro de Estadísticas y Calidad de la Salud del Comportamiento, 2015 ) y más de 1 millón están certificados para el uso de MMJ (Procon.org4 ), lo mejor para el público es desarrollar una comprensión sólida y basada en la evidencia de los efectos positivos y negativos del uso de MMJ en varios aspectos del funcionamiento: cognición, calidad de vida, salud física y emocional. A pesar de los intentos de realizar una investigación clínica empíricamente sólida, persisten una serie de barreras. Las restricciones sobre la investigación de MJ y muchos productos relacionados con MJ, incluidos los que tienen poco o ningún THC, se derivan exclusivamente del estado de MJ como sustancia de la Lista I. Han surgido esfuerzos en ciernes para hacer avanzar el campo, incluida la introducción de la Ley CARERS (Ley de Estado de Compasión, Acceso, Expansión de la Investigación y Respeto de 2015)5 ) y la Ley de acceso médico al cáñamo terapéutico (Ley de acceso médico al cáñamo terapéutico , 2015). Ambas leyes buscan, entre otros elementos de la agenda, excluir el CBD, así como las cepas de MJ con bajo contenido de THC / alto contenido de CBD (en otras palabras, productos no psicoactivos) de la definición actual de «marihuana» según la CSA para facilitar acceso a pacientes MMJ. Aunque ambos proyectos de ley se presentaron hace más de un año, su estado aún está pendiente. En su forma actual, los productos derivados del cáñamo industrial no psicoactivos (con bajo o nulo THC), que están ampliamente disponibles para la venta, no pueden estudiarse a través de ensayos de investigación clínica dadas las restricciones actuales. En consecuencia, los consumidores pueden acceder a estos productos que los investigadores clínicos no pueden evaluar en cuanto a eficacia y seguridad. A pesar de estos obstáculos, algunos avances han brindado esperanza a quienes buscan tratamientos alternativos. En abril de 2016,6 ). Aunque la DEA anunció a principios de este año que estaba reconsiderando la clasificación de MJ, una decisión publicada en agosto de 2016 reveló que MJ seguirá siendo una sustancia de la Lista I ( Departamento de Justicia, 2016a ). En un esfuerzo por promover los estudios de investigación clínica de MJ, la DEA indicó en cambio que permitirá que las «entidades» soliciten un registro de la DEA para hacer crecer su propio MJ para la investigación ( Departamento de Justicia, 2016b); esto contrasta con el protocolo actual que exige que todos los productos MJ derivados de plantas enteras que se utilicen para ensayos clínicos se obtengan de los Institutos Nacionales de Abuso de Drogas (NIDA). Si bien actualmente se están estudiando las investigaciones de los extractos purificados de cannabinoides individuales, en particular los ensayos de GW Pharma de Epidiolex, un producto de CBD purificado para niños con trastornos convulsivos intratables, algunos han informado que los productos derivados de botánicos de plantas enteras brindan una mayor mejora y alivio de los síntomas. ( Grinspoon y Bakalar, 1997 ; Joy et al., 1999 ), lo que subraya la necesidad de fuentes adicionales de productos MJ para ensayos clínicos.
Conclusiones
Los datos de la investigación actual proporcionan evidencia preliminar de que después de 3 meses de tratamiento, los usuarios de MMJ no experimentaron déficits en el funcionamiento ejecutivo, que a menudo se observan en usuarios recreativos habituales de MJ. De hecho, los pacientes con MMJ evidenciaron una mejora en ciertos aspectos del desempeño en estas medidas, particularmente con respecto al tiempo requerido para completar las tareas. Además, los pacientes informaron algunas mejoras en las medidas del estado clínico y la salud general, así como una disminución en los productos farmacéuticos convencionales, en particular el uso de opiáceos, que se redujo en un 42% entre la evaluación inicial y la visita 2. Si bien se necesitan estudios futuros para examinar más a fondo el impacto de MMJ, la investigación se ve obstaculizada por una serie de restricciones federales y estatales. Sin embargo, es imperativo que la investigación sólida, incluidos los ensayos clínicos bien controlados de los productos MMJ, muchos de los cuales ya son ampliamente utilizados por los pacientes, se examinan a fondo. A medida que avanza la “fiebre verde”, ganando impulso a medida que los estados continúan adoptando políticas menos restrictivas, no podemos permitirnos que la investigación continúe rezagada.
Contribuciones de autor
SG conceptualizó y diseñó el estudio actual en consulta con SL. KS y MD ayudaron a SG en la preparación del manuscrito. SG, KS, MR y RS reclutaron pacientes, llevaron a cabo los procedimientos del estudio y administraron evaluaciones neuropsicológicas y clínicas. MD también completó análisis estadísticos.
Fondos
Este proyecto fue financiado por generosas donaciones privadas al Programa de Investigaciones de Marihuana para el Descubrimiento Neurocientífico (MIND) en el Hospital McLean.
Declaracion de conflicto de interes
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Expresiones de gratitud
Los autores desean agradecer a Korine Cabrera y Ashley Lambros por su ayuda con la administración y puntuación de las evaluaciones neuropsicológicas y clínicas. Además, los autores agradecen a Integr8, Canna Care y al Dr. David Rideout de MMJ Physician Practice por su ayuda para facilitar el reclutamiento de pacientes.
Notas al pie
1. ^ Marihuana medicinal ProCon.org. (2016). Obtenido el 16 de junio de 2016 de http://medicalmarijuana.procon.org/
Procon org (2016). Número de pacientes con marihuana medicinal legal. Obtenido de http://medicalmarijuana.procon.org . 3 de marzo).
2. ^ Obtenido el 16 de junio de 2016, disponible en línea en: http://www.dea.gov/index.shtml
3. ^ Ley integral de prevención y control del abuso de drogas de 1970, Pub. L. No. 91-513, 84 Stat. 1236, 21 USC §812.
4. ^ Marihuana medicinal ProCon.org. (2016). Obtenido el 16 de junio de 2016 de http://medicalmarijuana.procon.org/
5. ^ Acta de acceso compasivo, expansión de la investigación y respeto de los estados de 2015, S. 683, 114th Cong. (2015).
6. ^ Clinicaltrials.gov. (2016). Obtenido el 29 de agosto de 2016 de https://clinicaltrials.gov/ct2/show/NCT02759185?term=%22sisley%22&rank=1
Referencias
Investigación de mercado de ArcView (2016). El estado de los mercados legales de marihuana, 2ª ed. Disponible en línea en: http://www.arcviewmarketresearch.com
Auer, R., Vittinghoff, E., Yaffe, K., Kunzi, A., Kertesz, SG, Levine, DA y col. (2016). Asociación entre el consumo de marihuana de por vida y la función cognitiva en la mediana edad: el estudio de desarrollo de riesgo de arteria coronaria en adultos jóvenes (CARDIA). Pasante de JAMA. Medicina. 176, 352–361. doi: 10.1001 / jamainternmed.2015.7841
PubMed Abstract | Texto completo CrossRef
Ballantyne, JC y Shin, NS (2008). Eficacia de los opioides para el dolor crónico: una revisión de la evidencia. Clin. J. Pain 24, 469–478. doi: 10.1097 / AJP.0b013e31816b2f26
PubMed Abstract | CrossRef Texto completo | Google Académico
Baron, EP (2015). Revisión exhaustiva de la marihuana medicinal, los cannabinoides y las implicaciones terapéuticas en la medicina y el dolor de cabeza: qué viaje tan largo y extraño ha sido… Headache 55, 885–916. doi: 10.1111 / head.12570
PubMed Abstract | CrossRef Texto completo | Google Académico
Beck, AT y Steer, RA (1990). Manual para el Inventario de ansiedad de Beck . San Antonio, TX: Corporación Psicológica.
Beck, AT, Ward, CH, Mendelson, M., Mock, J. y Erbaugh, J. (1961). Un inventario para medir la depresión. Arco. Psiquiatría general 4, 561–571. doi: 10.1001 / archpsyc.1961.01710120031004
PubMed Abstract | Texto completo CrossRef
Becker, MP, Collins, PF y Luciana, M. (2014). Neurocognición en consumidores diarios de marihuana en edad universitaria. J. Clin. Exp. Neuropsychol. 36, 379–398. doi: 10.1080 / 13803395.2014.893996
PubMed Abstract | CrossRef Texto completo | Google Académico
Beglinger, LJ, Gaydos, B., Tangphao-Daniels, O., Duff, D., Kareken, DA, Crawford, J. y col. (2005). Practique los efectos y el uso de formas alternativas en las pruebas neuropsicológicas seriadas. Arco. Clin. Neuropsychol. 20, 517–529. doi: 10.1016 / j.acn.2004.12.003
PubMed Abstract | CrossRef Texto completo | Google Académico
Berg, EA (1948). Una técnica objetiva simple para medir la flexibilidad en el pensamiento. J. Gen. Psychol. 39, 15-22. doi: 10.1080 / 00221309.1948.9918159
PubMed Abstract | CrossRef Texto completo | Google Académico
Bhattacharyya, S., Morrison, PD, Fusar-Poli, P., Martin-Santos, R., Borgwardt, S., Winton-Brown, T., et al. (2010). Efectos opuestos de delta-9-tetrahidrocannabinol y cannabidiol sobre la función del cerebro humano y la psicopatología. Neuropsychopharmacology 35, 764–774. doi: 10.1038 / npp.2009.184
PubMed Abstract | CrossRef Texto completo | Google Académico
Abedul, EA (1889). El uso de cáñamo indio en el tratamiento de la intoxicación crónica por cloral y opio. Lancet 133, 625. doi: 10.1016 / S0140-6736 (00) 30567-0
Bendición, EM, Steenkamp, MM, Manzanares, J. y Marmar, CR (2015). Cannabidiol como tratamiento potencial para los trastornos de ansiedad. Neurotherapeutics 12, 825–836. doi: 10.1007 / s13311-015-0387-1
PubMed Abstract | CrossRef Texto completo | Google Académico
Booth, M. (2003). Cannabis: una historia . Nueva York, NY: Picador.
Borelli, F., Fasolino, I., Romano, B., Capasso, R., Maiello, F., Coppola, D., et al. (2013). Efecto beneficioso del cannabinoide cannabigerol vegetal no psicotrópico sobre la enfermedad inflamatoria intestinal experimental. Biochem. Pharmacol. 85, 1306-1316. doi: 10.1016 / j.bcp.2013.01.017
PubMed Abstract | CrossRef Texto completo | Google Académico
Borgwardt, SJ, Allen, P., Bhattacharyya, S., Fusar-Poli, P., Crippa, JA, Seal, ML, et al. (2008). Bases neurales de delta-9-tetrahidrocannabinol y cannabidiol: efectos durante la inhibición de la respuesta. Biol. Psychiatry 64, 966–973. doi: 10.1016 / j.biopsych.2008.05.011
PubMed Abstract | CrossRef Texto completo | Google Académico
Boychuk, DG, Goddard, G., Mauro, G. y Orellana, MF (2015). La efectividad de los cannabinoides en el manejo del dolor neuropático crónico no maligno: una revisión sistemática. J. Dolor de cabeza por dolor facial oral 29, 7–14. doi: 10.11607 / ofph.1274
PubMed Abstract | CrossRef Texto completo | Google Académico
Braga, RJ, Burdick, KE, Derosse, P. y Malhotra, AK (2012). Resultados cognitivos y clínicos asociados con el consumo de cannabis en pacientes con trastorno bipolar I. Psiquiatría Res. 200, 242–245. doi: 10.1016 / j.psychres.2012.05.025
PubMed Abstract | CrossRef Texto completo | Google Académico
Buysse, DJ, Reynolds, CF 3rd., Monk, TH, Berman, SR y Kupfer, DJ (1989). El índice de calidad del sueño de Pittsburgh: un nuevo instrumento para la práctica y la investigación psiquiátricas. Psiquiatría Res. 28, 193-213. doi: 10.1016 / 0165-1781 (89) 90047-4
PubMed Abstract | CrossRef Texto completo | Google Académico
Centro de Calidad de Estadísticas de Salud Conductual (2015). Tendencias de la salud del comportamiento en los Estados Unidos: Resultados de la Encuesta nacional sobre el uso de drogas y la salud de 2014 (Publicación del HHS No. SMA 15-4927, Serie NSDUH H-50) . Disponible en línea en: http://www.samhsa.gov/data/ (Consultado el 16 de junio de 2016).
Centros para la Prevención del Control de Enfermedades, Centro Nacional de Salud, Archivo de Mortalidad del Sistema Nacional de Estadísticas Vitales de Estadísticas. (2015). Número y tasas ajustadas por edad de muertes por intoxicación por drogas que involucran analgésicos opioides y heroína: Estados Unidos, 2000-2014 . Atlanta, GA: Centro para el Control y la Prevención de Enfermedades. Disponible en línea en http://www.cdc.gov/nchs/data/health_policy/AADR_drug_poisoning_involving_OA_Heroin_US_2000-2014.pdf
Consroe, P., Laguna, J., Allender, J., Snider, S., Stern, L., Sandyk, R., et al. (1991). Ensayo clínico controlado de cannabidiol en la enfermedad de Huntington. Pharmacol. Biochem. Behav. 40, 701–708. doi: 10.1016 / 0091-3057 (91) 90386-G
PubMed Abstract | CrossRef Texto completo | Google Académico
Cousijn, J., Watson, P., Koenders, L., Vingerhoets, WA, Goudriaan, AE y Wiers, RW (2013). Dependencia del cannabis, control cognitivo y sesgo de atención para las palabras cannábicas. Adicto. Behav. 38, 2825–2832. doi: 10.1016 / j.addbeh.2013.08.011
PubMed Abstract | CrossRef Texto completo | Google Académico
Crane, NA, Schuster, RM y González, R. (2013). Evidencia preliminar de una relación específica por sexo entre la cantidad de consumo de cannabis y el rendimiento neurocognitivo en consumidores de cannabis adultos jóvenes. J. Int. Neuropsychol. Soc. 19, 1009-1015. doi: 10.1017 / S135561771300088X
PubMed Abstract | CrossRef Texto completo | Google Académico
Crane, NA, Schuster, RM, Mermelstein, RJ y González, R. (2015). Diferencias de sexo neuropsicológicas asociadas con la edad de inicio del uso entre los consumidores de cannabis adultos jóvenes. J. Clin. Exp. Neuropsychol. 37, 389–401. doi: 10.1080 / 13803395.2015.1020770
PubMed Abstract | CrossRef Texto completo | Google Académico
Crean, RD, Crane, NA y Mason, BJ (2011). Una revisión basada en evidencia de los efectos agudos y a largo plazo del consumo de cannabis en las funciones cognitivas ejecutivas. J. Addict. Medicina. 5, 1–8. doi: 10.1097 / ADM.0b013e31820c23fa
PubMed Abstract | CrossRef Texto completo | Google Académico
Dahlgren, MK, Sagar, KA, Racine, MT, Dreman, MW y Gruber, SA (2016). El consumo de marihuana predice el rendimiento cognitivo en tareas de la función ejecutiva. J. Stud. Drogas alcohólicas 77, 298-308. doi: 10.15288 / jsad.2016.77.298
PubMed Abstract | CrossRef Texto completo | Google Académico
Degenhardt, L., Lintzeris, N., Campbell, G., Bruno, R., Cohen, M., Farrell, M. y col. (2015). Experiencia del uso de cannabis como adyuvante para el dolor crónico no relacionado con el cáncer: hallazgos del estudio Pain and Opioids IN Treatment (POINT). Depende del alcohol de drogas. 147, 144-150. doi: 10.1016 / j.drugalcdep.2014.11.031
PubMed Abstract | CrossRef Texto completo | Google Académico
Departamento de Justicia (2016a). Denegación de petición para iniciar procedimientos para reprogramar marihuana (21 CFR Capítulo II, Expediente No. DEA-427). Springfield, VA: Administración de Control de Drogas.
Departamento de Justicia (2016b). Solicitudes para registrarse bajo la Ley de Sustancias Controladas para la Fabricación de Marihuana para Investigadores de Suministro en los Estados Unidos (21 CFR Parte 1301, Expediente No. DEA-447) . Springfield, VA: Administración de Control de Drogas.
Deshpande, A., Mailis-Gagnon, A., Zoheiry, N. y Lakha, SF (2015). Eficacia y efectos adversos de la marihuana medicinal para el dolor crónico no relacionado con el cáncer: revisión sistemática de ensayos controlados aleatorios. Lata. Fam. Médico 61, E372 – E381.
Devinsky, O., Marsh, E., Friedman, D., Thiele, E., Laux, L., Sullivan, J. y col. (2016). Cannabidiol en pacientes con epilepsia resistente al tratamiento: un ensayo intervencionista de etiqueta abierta. Lancet Neurol. 15, 170-178. doi: 10.1016 / S1474-4422 (15) 00379-8
PubMed Abstract | CrossRef Texto completo | Google Académico
Dougherty, DM, Mathias, CW, Dawes, MA, Furr, RM, Charles, NE, Liguori, A., et al. (2013). Impulsividad, atención, memoria y toma de decisiones en adolescentes consumidores de marihuana. Psicofarmacología (Berl). 226, 307–319. doi: 10.1007 / s00213-012-2908-5
PubMed Abstract | CrossRef Texto completo | Google Académico
Ehrenreich, H., Rinn, T., Kunert, HJ, Moeller, MR, Poser, W., Schilling, L., et al. (1999). Disfunción de la atención específica en adultos tras el inicio temprano del consumo de cannabis. Psicofarmacología (Berl). 142, 295-301. doi: 10.1007 / s002130050892
PubMed Abstract | CrossRef Texto completo | Google Académico
Eisenberg, E., Ogintz, M. y Almog, S. (2014). La farmacocinética, la eficacia, la seguridad y la facilidad de uso de un nuevo inhalador portátil de cannabis de dosis medida en pacientes con dolor neuropático crónico: un estudio de fase 1a. J. Pain Palliat. Cuidado Pharmacother. 28, 216–225. doi: 10.3109 / 15360288.2014.941130
PubMed Abstract | CrossRef Texto completo | Google Académico
ElSohly, MA, Mehmedic, Z., Foster, S., Gon, C., Chandra, S. y Church, JC (2016). Cambios en la potencia del cannabis durante las últimas 2 décadas (1995-2014): análisis de datos actuales en los Estados Unidos. Biol. Psychiatry 79, 613–619. doi: 10.1016 / j.biopsych.2016.01.004
PubMed Abstract | CrossRef Texto completo | Google Académico
Englund, A., Morrison, PD, Nottage, J., Hague, D., Kane, F., Bonaccorso, S. y col. (2013). El cannabidiol inhibe los síntomas paranoides provocados por el THC y el deterioro de la memoria dependiente del hipocampo. J. Psychopharmacol. 27, 19-27. doi: 10.1177 / 0269881112460109
PubMed Abstract | CrossRef Texto completo | Google Académico
Englund, A., Atakan, Z., Kralj, A., Tunstall, N., Murray, R. y Morrison, P. (2016). El efecto de la dosificación de cinco días con THCV sobre los efectos cognitivos, psicológicos y fisiológicos inducidos por el THC en voluntarios humanos varones sanos: un ensayo piloto cruzado, doble ciego y controlado con placebo. J. Psychopharmacol. (Oxford). 30, 140-151. doi: 10.1177 / 0269881115615104
PubMed Abstract | CrossRef Texto completo | Google Académico
Flachenecker, P., Henze, T. y Zettl, Reino Unido (2014). Nabiximols (THC / CBD en spray bucal, Sativex®) en la práctica clínica: resultados de un estudio multicéntrico no intervencionista (MOVE 2) en pacientes con espasticidad por esclerosis múltiple. EUR. Neurol. 71, 271-279. doi: 10.1159 / 000357427
PubMed Abstract | CrossRef Texto completo | Google Académico
Fontes, MA, Bolla, KI, Cunha, PJ, Almeida, PP, Jungerman, F., Laranjeira, RR, et al. (2011). Consumo de cannabis antes de los 15 años y posterior funcionamiento ejecutivo. Br. J. Psychiatry 198, 442–447. doi: 10.1192 / bjp.bp.110.077479
PubMed Abstract | CrossRef Texto completo | Google Académico
Fried, PA, Watkinson, B. y Gray, R. (2005). Consecuencias neurocognitivas de la marihuana: una comparación con el rendimiento antes de la medicación. Neurotoxicol. Teratol. 27, 231-239. doi: 10.1016 / j.ntt.2004.11.003
PubMed Abstract | CrossRef Texto completo | Google Académico
Giacoppo, S., Soundara Rajan, T., Galuppo, M., Pollastro, F., Grassi, G., Bramanti, P., et al. (2015). El cannabidiol purificado, el principal componente no psicotrópico del Cannabis sativa, por sí solo, contrarresta la apoptosis neuronal en la esclerosis múltiple experimental. EUR. Rev. Med. Pharmacol. Sci. 19, 4906–4919.
PubMed Abstract | Google Académico
Giedd, JN, Blumenthal, J., Jeffries, NO, Castellanos, FX, Liu, H., Zijdenbos, A., et al. (1999). Desarrollo del cerebro durante la infancia y la adolescencia: un estudio de resonancia magnética longitudinal. Nat. Neurosci. 2, 861–863. doi: 10.1038 / 13158
PubMed Abstract | CrossRef Texto completo | Google Académico
Grinspoon, L. y Bakalar, JB (1997). Marihuana: la medicina prohibida . New Haven, CT: Prensa de la Universidad de Yale.
Gruber, SA, Dahlgren, MK, Sagar, KA, Gönenc, A. y Killgore, WD (2012b). La edad de inicio del consumo de marihuana afecta el procesamiento inhibitorio. Neurosci. Letón. 511, 89–94. doi: 10.1016 / j.neulet.2012.01.039
PubMed Abstract | Texto completo CrossRef
Gruber, SA, Dahlgren, MK, Sagar, KA, Gonenc, A. y Lukas, SE (2014). Vale la pena esperar: efectos de la edad de inicio del consumo de marihuana sobre la materia blanca y la impulsividad. Psicofarmacología (Berl). 231, 1455-1465. doi: 10.1007 / s00213-013-3326-z
PubMed Abstract | CrossRef Texto completo | Google Académico
Gruber, SA, Sagar, KA, Dahlgren, MK, Racine, M. y Lukas, SE (2012a). Edad de inicio del consumo de marihuana y función ejecutiva. Psychol. Adicto. Behav. 26, 496–506. doi: 10.1037 / a0026269
PubMed Abstract | CrossRef Texto completo | Google Académico
Gul, A. y Humphreys, GW (2015). Práctica e integración de palabras y colores en la interferencia de Stroop. Psicológica 36, 37–67.
Hanson, KL, Thayer, RE y Tapert, SF (2014). Los consumidores adolescentes de marihuana tienen una mayor asunción de riesgos en la tarea del riesgo del análogo de globo. J. Psychopharmacol. (Oxford). 28, 1080-1087. doi: 10.1177 / 0269881114550352
PubMed Abstract | CrossRef Texto completo | Google Académico
Haroutounian, S., Ratz, Y., Ginosar, Y., Furmanov, K., Saifi, F., Meidan, R., et al. (2016). El efecto del cannabis medicinal sobre el dolor y los resultados de la calidad de vida en el dolor crónico: un estudio prospectivo de etiqueta abierta. Clin. J. Pain . doi: 10.1097 / ajp.0000000000000364. [Publicación electrónica antes de la impresión].
PubMed Abstract | CrossRef Texto completo | Google Académico
Izzo, AA, Capasso, R., Aviello, G., Borrelli, F., Romano, B., Piscitelli, F., et al. (2012). Efecto inhibidor del cannabicromeno, un importante cannabinoide no psicotrópico extraído de Cannabis sativa, sobre la hipermotilidad inducida por inflamación en ratones. Br. J. Pharmacol. 166, 1444-1460. doi: 10.1111 / j.1476-5381.2012.01879.x
PubMed Abstract | CrossRef Texto completo | Google Académico
Jackson, Nueva Jersey, Isen, JD, Khoddam, R., Irons, D., Tuvblad, C., Iacono, WG y col. (2016). Impacto del consumo de marihuana en adolescentes en la inteligencia: resultados de dos estudios longitudinales de gemelos. Proc. Natl. Acad. Sci. USA 113, E500 – E508. doi: 10.1073 / pnas.1516648113
PubMed Abstract | CrossRef Texto completo | Google Académico
Jacobus, J., Squeglia, LM, Infante, MA, Castro, N., Brumback, T., Meruelo, AD, et al. (2015). Rendimiento neuropsicológico en consumidores de marihuana adolescentes con consumo concurrente de alcohol: un estudio longitudinal de tres años. Neuropsychology 29, 829–843. doi: 10.1037 / neu0000203
PubMed Abstract | CrossRef Texto completo | Google Académico
Jacobus, J. y Tapert, SF (2014). Efectos del cannabis en el cerebro adolescente. Curr. Pham. Des. 20, 2186–2193. doi: 10.2174 / 13816128113199990426
PubMed Abstract | CrossRef Texto completo | Google Académico
Johnston, L., O’Malley, P., Miech, R., Bachman, J. y Schulenberg, J. (2015). Seguimiento de los resultados de la futura encuesta nacional sobre el consumo de drogas: 1975-2015: Resumen: Hallazgos clave sobre el consumo de drogas en los adolescentes. Ann Arbor, MI: Instituto de Investigación Social, Universidad de Michigan.
Joy, JE, Watson, SJ y Benson, JA (1999). Marihuana y medicina: evaluación de la base científica . Washington, DC: Prensa de la Academia Nacional.
Leweke, FM, Piomelli, D., Pahlisch, F., Muhl, D., Gerth, CW, Hoyer, C. y col. (2012). El cannabidiol mejora la señalización de anandamida y alivia los síntomas psicóticos de la esquizofrenia. Transl. Psiquiatría 2: e94. doi: 10.1038 / tp.2012.15
PubMed Abstract | CrossRef Texto completo | Google Académico
Lezak, MD, Howieson, DB y Loring, DW (2004). Evaluación neuropsicológica, 4ª ed . Oxford: Prensa de la Universidad de Oxford.
Lisdahl, KM, Gilbart, ER, Wright, NE y Shollenbarger, S. (2013). ¿Te atreves a retrasar? Los impactos del consumo de alcohol y marihuana en los adolescentes sobre la cognición, la estructura y la función del cerebro. Parte delantera. Psiquiatría 4:53. doi: 10.3389 / fpsyt.2013.00053
PubMed Abstract | CrossRef Texto completo | Google Académico
Lisdahl, KM y Price, JS (2012). El mayor consumo de marihuana y el género predicen un peor funcionamiento cognitivo en adolescentes y adultos emergentes. J. Int. Neuropsychol. Soc. 18, 678–688. doi: 10.1017 / S1355617712000276
PubMed Abstract | CrossRef Texto completo | Google Académico
Lisdahl, KM, Wright, NE, Kirchner-Medina, C., Maple, KE y Shollengarger, S. (2014). Considerando el cannabis: los efectos del consumo habitual de cannabis sobre la neurocognición en adolescentes y adultos jóvenes. Curr. Adicto. Reports 1, 144-156. doi: 10.1007 / s40429-014-0019-6
CrossRef Texto completo | Google Académico
MacLeod, CM (1991). Medio siglo de investigación sobre el efecto estroboscópico: una revisión integradora. Psychol. Toro. 109, 163-203. doi: 10.1037 / 0033-2909.109.2.163
PubMed Abstract | CrossRef Texto completo | Google Académico
Medina, KL, Hanson, KL, Schweinsburg, AD, Cohen-Zion, M., Nagel, BJ y Tapert, SF (2007). Funcionamiento neuropsicológico en consumidores adolescentes de marihuana: déficits sutiles detectables después de un mes de abstinencia. J. Int. Neuropsychol. Soc. 13, 807–820. doi: 10.1017 / S1355617707071032
PubMed Abstract | CrossRef Texto completo | Google Académico
Meier, MH, Caspi, A., Ambler, A., Harrington, H., Houts, R., Keefe, RS y col. (2012). Los consumidores persistentes de cannabis muestran un deterioro neuropsicológico desde la infancia hasta la mediana edad. Proc. Natl. Acad. Sci. USA 109, E2657 – E2664. doi: 10.1073 / pnas.1206820109
PubMed Abstract | CrossRef Texto completo | Google Académico
Mokrysz, C., Landy, R., Gage, SH, Munafo, MR, Rosier, JP y Curran, HV (2016). ¿El coeficiente intelectual y los resultados educativos de los adolescentes están relacionados con el consumo de cannabis? Un estudio de cohorte prospectivo. J. Psychopharm. 30, 159-168. doi: 10.1177 / 0269881115622241
PubMed Abstract | CrossRef Texto completo | Google Académico
Morgan, CJ, Gardener, C., Schafer, G., Swan, S., Demarchi, C., Freeman, TP y col. (2012). Impacto subcrónico de los cannabinoides en el cannabis callejero sobre la cognición, los síntomas de tipo psicótico y el bienestar psicológico. Psychol. Medicina. 42, 391–400. doi: 10.1017 / S0033291711001322
PubMed Abstract | CrossRef Texto completo | Google Académico
Morgan, CJ, Schafer, G., Freeman, TP y Curran, HV (2010). Impacto del cannabidiol en la memoria aguda y los efectos psicotomiméticos del cannabis fumado: estudio naturalista. Br. J. Psychiatry 197, 285-290. doi: 10.1192 / bjp.bp.110.077503
PubMed Abstract | CrossRef Texto completo | Google Académico
Moriarty, O., McGuire, BE y Finn, DP (2011). El efecto del dolor en la función cognitiva: una revisión de la investigación clínica y preclínica. Prog. Neurobiol. 93, 385–404. doi: 10.1016 / j.pneurobio.2011.01.002
PubMed Abstract | CrossRef Texto completo | Google Académico
Nunberg, H., Kilmer, B., Pacula, RL y Burgdorf, J. (2013). Un análisis de los solicitantes que se presentan a una práctica especializada en marihuana medicinal en California. J. Política de Drogas Anal. 4: 1. doi: 10.2202 / 1941-2851.1017
PubMed Abstract | CrossRef Texto completo | Google Académico
Patti, F., Messina, S., Solaro, C., Amato, MP, Bergamaschi, R., Bonavita, S., et al. (2016). Eficacia y seguridad del aerosol bucal cannabinoide para la espasticidad de la esclerosis múltiple. J. Neurol Neurosurg. Psiquiatría. 87, 944–951. doi: 10.1136 / jnnp-2015-312591
PubMed Abstract | CrossRef Texto completo | Google Académico
Patton, JH, Stanford, MS y Barratt, ES (1995). Estructura factorial de la escala de impulsividad de Barratt. J. Clin. Psychol. 51, 768–774.
PubMed Abstract | Google Académico
Pollock, V., Cho, DW, Reker, D. y Volavka, J. (1979). Perfil de los estados de ánimo: los factores y sus correlatos fisiológicos. J. Nerv. Ment. Dis. 167, 612–614. doi: 10.1097 / 00005053-197910000-00004
PubMed Abstract | CrossRef Texto completo | Google Académico
Pope, HG, Gruber, AJ, Hudson, JI, Cohane, G., Huestis, MA y Yurgelun-Todd, D. (2003). Consumo de cannabis de inicio temprano y déficits cognitivos: ¿cuál es la naturaleza de la asociación? Depende del alcohol de drogas. 69, 303–310. doi: 10.1016 / S0376-8716 (02) 00334-4
PubMed Abstract | CrossRef Texto completo | Google Académico
Potter, SOL (1917). “Cannabis”, en Terapéutica, Materia Médica y Farmacia; La terapéutica especial de enfermedades y síntomas, las acciones fisiológicas y terapéuticas de los medicamentos, la materia médica moderna, la farmacia oficial y práctica, la redacción de recetas y el tratamiento antídoto y antagonista de las intoxicaciones , ed EH Funk (Filadelfia, PA: Blakiston Son & Co) , 195-197.
Press, CA, Knupp, KG y Chapman, KE (2015). Informe de los padres de la respuesta a los extractos de cannabis oral para el tratamiento de la epilepsia refractaria. Epilepsy Behav. 45, 49–52. doi: 10.1016 / j.yebeh.2015.02.043
PubMed Abstract | CrossRef Texto completo | Google Académico
Ringen, PA, Vaskinn, A., Sundet, K., Engh, JA, Jonsdottir, H., Simonsen, C., et al. (2010). Relaciones opuestas entre el consumo de cannabis y el funcionamiento neurocognitivo en el trastorno bipolar y la esquizofrenia. Psychol. Medicina. 40, 1337-1347. doi: 10.1017 / S0033291709991620
PubMed Abstract | CrossRef Texto completo | Google Académico
Rosenblum, A., Marsch, LA, Joseph, H. y Portenoy, RK (2008). Los opioides y el tratamiento del dolor crónico: controversias, estado actual y direcciones futuras. Exp. Clin. Psychopharmacol. 16, 405–416. doi: 10.1037 / a0013628
PubMed Abstract | CrossRef Texto completo | Google Académico
Ryan-Ibarra, S., Induni, M. y Ewing, D. (2015). Prevalencia del uso de marihuana medicinal en California, 2012. Drogas Alcohol Rev. 34, 141-146. doi: 10.1111 / dar.12207
PubMed Abstract | CrossRef Texto completo | Google Académico
Sagar, KA, Dahlgren, MK, Gönenç, A., Racine, MT, Dreman, MW y Gruber, SA (2015). El impacto de la iniciación: los fumadores de marihuana de inicio temprano demuestran una activación cerebral y un rendimiento de Stroop alterados. Dev. Cogn. Neurosci. 16, 84–92. doi: 10.1016 / j.dcn.2015.03.003
PubMed Abstract | CrossRef Texto completo | Google Académico
Sagar, KA, Dahlgren, MK, Racine, MT, Dreman, MW, Olson, DP y Gruber, SA (2016). Efectos conjuntos: una investigación piloto del impacto del trastorno bipolar y el consumo de marihuana en la función cognitiva y el estado de ánimo. PLoS ONE 11: e0157060. doi: 10.1371 / journal.pone.0157060
PubMed Abstract | CrossRef Texto completo | Google Académico
Shinjyo, N. y Di Marzo, V. (2013). El efecto del cannabicromeno sobre las células madre / progenitoras neurales adultas. Neurochem. En t. 63, 432–437. doi: 10.1016 / j.neuint.2013.08.002
PubMed Abstract | CrossRef Texto completo | Google Académico
Shuster, RM, Hoeppner, SS, Evins, AE y Gilman, JM (2016). El consumo de marihuana de inicio temprano se asocia con deficiencias en el aprendizaje. Neuropsychology 30, 405–415. doi: 10.1037 / neu0000281
PubMed Abstract | CrossRef Texto completo | Google Académico
Silver, C. (2 de junio de 2016). La $fiebre verde de 40 mil millones de dólares de la marihuana . Forbes . Disponible en línea en: http://www.forbes.com .
Sobell, LC, Sobell, MB, Leo, GI y Cancilla, A. (1998). Fiabilidad de un método de línea de tiempo: evaluación de los informes de bebedores normales sobre consumo reciente y una evaluación comparativa en varias poblaciones. Br. J. Addict. 83, 393–402. doi: 10.1111 / j.1360-0443.1988.tb00485.x
PubMed Abstract | CrossRef Texto completo | Google Académico
Solowij, N., Jones, KA, Rozman, ME, Davis, SM, Ciarrochi, J., Heaven, PC, et al. (2012). Reflexión impulsividad en adolescentes consumidores de cannabis: una comparación con adolescentes consumidores de alcohol y no consumidores de sustancias. Psicofarmacología (Berl). 219, 575–586. doi: 10.1007 / s00213-011-2486-y
PubMed Abstract | CrossRef Texto completo | Google Académico
Tait, RJ, Mackinnon, A. y Christensen, H. (2011). Consumo de cannabis y función cognitiva: trayectoria de 8 años en una cohorte de adultos jóvenes. Addiction 106, 2195-2203. doi: 10.1111 / j.1360-0443.2011.03574.x
PubMed Abstract | CrossRef Texto completo | Google Académico
Tamm, L., Epstein, JN, Lisdahl, KM, Molina, B., Tapert, S., Hinshaw, SP y col. (2013). Impacto del TDAH y el consumo de cannabis en el funcionamiento ejecutivo en adultos jóvenes. Depende del alcohol de drogas. 133, 607–614. doi: 10.1016 / j.drugalcdep.2013.08.001
PubMed Abstract | CrossRef Texto completo | Google Académico
Ley de acceso médico al cáñamo terapéutico (2015). Ley de acceso médico de cáñamo terapéutico de 2015. S. 1333, 114th Cong.
Valdeolivas, S., Navarrete, C., Cantarero, I., Bellido, ML, Munoz, E. y Sagredo, O. (2015). Propiedades neuroprotectoras del cannabigerol en la enfermedad de Huntington: estudios en ratones R6 / 2 y ratones lesionados con 3-nitropropionato. Neurotherapeutics 12, 185-199. doi: 10.1007 / s13311-014-0304-z
PubMed Abstract | CrossRef Texto completo | Google Académico
Vytal, KE, Cornwell, BR, Letkiewicz, AM, Arkin, NE y Grillon, C. (2013). La interacción compleja entre ansiedad y cognición: conocimiento de la memoria de trabajo espacial y verbal. Parte delantera. Tararear. Neurosci. 7:93. doi: 10.3389 / fnhum.2013.00093
PubMed Abstract | CrossRef Texto completo | Google Académico
Wachtel, SR, ElSohly, MA, Ross, SA, Ambre, J. y de Wit, H. (2002). Comparación de los efectos subjetivos del Δ 9 -tetrahidrocannabinol y la marihuana en humanos. Psicofarmacología (Berl). 161, 331–339. doi: 10.1007 / s00213-002-1033-2
PubMed Abstract | CrossRef Texto completo | Google Académico
Ware, JE Jr. y Sherbourne, CD (1992). Encuesta de salud de formato corto de 36 ítems MOS (SF-36). I. Marco conceptual y selección de ítems. Medicina. Care 30, 473–483.
PubMed Abstract | Google Académico
Wechsler, D. (1997). Escala de inteligencia de adultos de Wechsler, 3.a ed. (WAIS-III) . San Antonio, TX: Evaluación de Harcourt.
Wechsler, D. (1999). Escala de inteligencia abreviada de Wechsler . San Antonio, TX: The Psychological Corporation, Hartcourt Brace and Company.
Whiting, PF, Wolff, RF, Deshpande, S., Di Nisio, M., Duffy, S., Hernandez, A., et al. (2015). Cannabinoides para uso médico: una revisión sistemática y un metanálisis. JAMA 313, 2456–2473. doi: 10.1001 / jama.2015.6358
PubMed Abstract | Texto completo CrossRef
Wilkie, G., Sakr, B. y Rizack, T. (2016). Uso de marihuana medicinal en oncología: una revisión. JAMA Oncol. doi: 10.1001 / jamaoncol.2016.0155. [Publicación electrónica antes de la impresión].
PubMed Abstract | Texto completo CrossRef
Winward, JL, Hanson, KL, Tapert, SF y Brown, SA (2014). El consumo excesivo de alcohol, el consumo de marihuana y el consumo concomitante por parte de los adolescentes se asocian con disminuciones cognitivas únicas y compartidas. J. Int. Neuropsychol. Soc. 20, 784–795. doi: 10.1017 / S1355617714000666
PubMed Abstract | CrossRef Texto completo | Google Académico
Zeiger, JS, Haberstick, BC, Corley, RP, Ehringer, MA, Crowley, TJ, Hewitt, J., et al. (2010). Efectos subjetivos de la marihuana asociados con el consumo de marihuana en la comunidad y sujetos clínicos. Depende del alcohol de drogas. 109, 161-166. doi: 10.1016 / j.drugalcdep.2009.12.026
PubMed Abstract | CrossRef Texto completo | Google Académico
Zuardi, AW, Crippa, JA, Hallak, JE, Bhattacharyya, S., Atakan, Z., Martin-Santos, R., et al. (2012). Una revisión crítica de los efectos antipsicóticos del cannabidiol: 30 años de investigación traslacional. Curr. Pharm. Des. 18, 5131–5140. doi: 10.2174 / 138161212802884681
PubMed Abstract | CrossRef Texto completo | Google Académico
Zuardi, AW, Crippa, JA, Hallak, JE, Pinto, JP, Chagas, MH, Rodrigues, GG, et al. (2009). Cannabidiol para el tratamiento de la psicosis en la enfermedad de Parkinson. J. Psychopharmacol. (Oxford). 23, 979–83. doi: 10.1177 / 0269881108096519
PubMed Abstract | CrossRef Texto completo | Google Académico
Palabras clave: marihuana medicinal, cannabis, cognición, función ejecutiva, THC, cannabidiol
Cita: Gruber SA, Sagar KA, Dahlgren MK, Racine MT, Smith RT y Lukas SE (2016) Splendor in the Grass? Un estudio piloto que evalúa el impacto de la marihuana medicinal en la función ejecutiva. Parte delantera. Pharmacol . 7: 355. doi: 10.3389 / fphar.2016.00355
Recibido: 30 de junio de 2016; Aprobado: 20 de septiembre de 2016;
Publicado: 13 de octubre de 2016.
Editado por:Allyn C. Howlett , Facultad de Medicina de Wake Forest, EE. UU.
Revisado por:Ronald P. Hammer , Universidad de Arizona, EE. UU.
Rink-Jan Lohman , Universidad de Queensland, Australia
Copyright © 2016 Gruber, Sagar, Dahlgren, Racine, Smith y Lukas. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia de atribución Creative Commons (CC BY) . Se permite el uso, distribución o reproducción en otros foros, siempre que se acredite al autor (es) original (es) o al licenciante y se cite la publicación original en esta revista, de acuerdo con la práctica académica aceptada. No se permite ningún uso, distribución o reproducción que no cumpla con estos términos.
* Correspondencia: Staci A. Gruber, gruber@mclean.harvard.edu
Descargo de responsabilidad: Todas las afirmaciones expresadas en este artículo son únicamente de los autores y no representan necesariamente las de sus organizaciones afiliadas o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
