
Luigi L Romano, Arno Hazekamp
1Departmento de Farmacia, Universidad de Siena, Italia
2Grupo Metabolómico de Plantas, Instituto de Biología, Universidad de Leiden, Países Bajos
Resumen
Los extractos de cannabis concentrados, también conocidos como aceites de cannabis pese a su aspecto pegajoso y viscoso, son cada vez más populares entre los pacientes automedicados que lo reivindican como cura del cáncer. En general, los métodos de preparación de los aceites de cannabis son relativamente simples y no requieren instrumentos especiales. El ejemplo más conocido de este tipo de producto es el denominado ‘aceite de Simpson’. El propósito de la extracción, a menudo seguida de una fase de evaporación del disolvente, es hacer que los cannabinoides y otros componentes beneficiosos como los terpenos se encuentren disponibles en forma altamente concentrada. Aunque se han recomendado varios métodos de preparación para los aceites de cannabis, hasta ahora no hay estudios que hayan notificado sobre su composición química.
Reconociendo la necesidad de más información sobre los problemas de calidad y seguridad con respecto a los aceites de cannabis, se realizó un estudio analítico para comparar varios métodos habituales de preparación utilizados en base al contenido de cannabinoides, terpenos y residuos del disolvente. Estos últimos incluyeron el etanol, la nafta, el éter de petróleo y el aceite de oliva. Los resultados obtenidos no tienen el propósito de apoyar o negar las propiedades terapéuticas de estos productos, sino poder ser de utilidad para un mejor entendimiento de las experiencias de los pacientes automedicados mediante el análisis químico de esta popular terapia.
Introducción
Los cannabinoides tienen efectos paliativos en pacientes con cáncer mediante la reducción de las náuseas, los vómitos y el dolor, y por estimulación del apetito [1]. Además, la evidencia preclínica ha demostrado que los cannabinoides son capaces, bajo determinadas circunstancias, de inhibir el desarrollo de las células cancerosas por varios mecanismos de acción, que incluyen la apoptosis, la inhibición de la angiogénesis y la detención del ciclo celular [2,3].
Como consecuencia de tales emocionantes resultados, han aumentado el número de vídeos y reportajes en Internet
argumentando que el cannabis puede curar el cáncer. Pero aunque en la actualidad se investiga ésta cuestión en países de todo el mundo, aun no existe evidencia clínica sólida para demostrar que los cannabinoides, ya sean naturales o sintéticos, puedan tratar eficazmente el cáncer en humanos. Por tanto es importante tener cuidado al extrapolar los resultados preclínicos a los pacientes.
Los informes anecdóticos sobre el uso del cannabis han sido históricamente útiles para proporcionar pistas sobre los procesos biológicos controlados por el sistema endocannabinoide y los posibles beneficios terapéuticos de los cannabinoides. El efecto terapéutico de éstos como antiemético [4], estimulante del apetito [5], analgésico [6], relajante muscular [7] y para el síndrome de Tourette [8] fueron todos descubiertos así. Pero si bien es posible -e incluso deseable- que las preparaciones de cannabis exhiban actividad antineoplásica en, al menos, algunos enfermos de cáncer, la evidencia anecdótica actual disponible sobre este tema sigue siendo pobre y, por desgracia, están lejos de apoyar que los cannabinoides sean medicamentos eficaces contra el cáncer para grandes poblaciones de pacientes [9]. Cabe señalar, sin embargo, que los potenciales efectos de los terpenos sobre el cáncer, ya sean solos o en combinación con los cannabinoides, aún no se han abordado en estudios de laboratorio. De hecho, el efecto sinérgico entre los cannabinoides y los terpenos a menudo es la mayor y diferente argumentación entre los preparados «holísticos» a base de la hierba completa de cannabis y los productos basados en cannabinoides aislados [10]. Por otra parte, los enfermos que se automedican a menudo usan métodos de extracción y/o formas de administración muy
diferentes de las condiciones utilizadas en los estudios (pre)clínicos, dando lugar posiblemente a diferentes
perfiles de cannabinoides y sus metabolitos en sangre [11] y, en consecuencia, en diferentes efectos terapéuticos.
Debido a esta brecha entre la investigación clínica y las experiencias reales, el potencial curativo de los preparados de cannabis íntegro para el tratamiento de diferentes tipos de cáncer sigue estando poco claro.
En los últimos años un número creciente de pacientes han utilizado extractos concentrados de hierba de cannabis, lo que debido a su aspecto pegajoso y viscoso se conoce como «aceite de cannabis». Entre la población automedicada se creía firmemente que estos productos son capaces de curar el cáncer, una afirmación que está respaldada por numerosas historias anecdóticas de enfermos. El aceite de cannabis es un extracto concentrado obtenido por extracción con disolventes de las flores y hojas de la planta de cannabis. Se han recomendado para este propósito varios disolventes no polares, incluyendo el éter de petróleo, la nafta, el alcohol y el aceite de oliva. El objetivo de la extracción, a menudo seguido por una etapa de evaporación del disolvente, es hacer que los cannabinoides y otros
componentes beneficiosos como los terpenos, se encuentren disponibles en forma altamente concentrada. En general, los métodos de preparación del aceite de cannabis son relativamente simples y no requieren instrumentos especiales. por esta razón las personas que tienen acceso al cannabis, ya sea de cosecha propia u obtenido mediante receta en farmacias, dispensarios, coffee-shops o el mercado negro, pueden prepararlo en casa ellos mismos.
En particular, la cautivadora historia de un ex-paciente llamado Rick Simpson, canadiense que afirma haber curado su cáncer de piel a través de la aplicación tópica repetida de aceite de cannabis producida de acuerdo con su propia receta, ha recibido de una creciente atención. Su historia detallada se describe en su página web [12] y en una película documental llamada «Run from the cure» [13], donde varios enfermos con cáncer describen los efectos terapéuticos del aceite ‘Simpson’ para sus enfermedades. Tanto en el sitio web como en el documental se explica con detalle cómo preparar y administrar el producto. El método sugiere el uso de la nafta o del éter de petróleo como disolventes para la extracción, sin especificar una calidad o fuente particular. Ambos disolventes son una mezcla de hidrocarburos de petróleo (HCPs), a menudo disponibles en una amplia gama de calidades. En general el éter de petróleo y la nafta se refieren a productos muy similares, a pesar de que en todo el mundo se utilizan diferentes nombres, por ejemplo en algunos países la nafta es equivalente al diesel o al combustible queroseno. Como resultado, se pueden encontrar en los foros de Internet un amplio debate sobre la elección del disolvente. Tras el éxito del aceite de Simpson, han surgido
una serie de recetas parecidas que hacen énfasis en pequeños pero significativos cambios con la receta original. Los ejemplos incluyen el enfoque en la extracción mediante disolventes más seguros como el etanol [14], o en la prevención a la exposición a disolventes orgánicos con el uso de aceite de oliva [15].
Dado que el cáncer es una enfermedad devastadora que afecta a una gran proporción de la población mundial, algunos enfermos buscan tratamientos alternativos fuera del ámbito de la medicina moderna. Con un creciente interés en los aceites de cannabis para la automedicación, es importante no pasar por alto la importancia del control de calidad y la estandarización.
En este sentido hay que señalar que ninguno de los métodos de producción del aceite de cannabis ha sido validado por la literatura publicada y tampoco se han presentado informes sobre la composición química de estos productos.
Como resultado, aunque muchos creen que el aceite de cannabis puede curar el cáncer, nadie parece saber lo que realmente contiene. En cambio, los efectos positivos del aceite de cannabis están basados casi exclusivamente en informes de casos de personas que lo han utilizado. Este documento evalúa los efectos de los métodos de preparación, y en particular los disolventes utilizados, en la composición final de los diferentes aceites de cannabis. Los resultados obtenidos no tienen el propósito de apoyar o negar sus propiedades terapéuticas, sino ser de utilidad para un mejor entendimiento de las experiencias de los pacientes automedicados mediante el análisis químico de este popular fármaco.
Materiales y Métodos
Material vegetal
El material de la planta de cannabis utilizado en este estudio fue de la variedad ‘Bedrocan’ (19% de THC p/p) y se obtuvo de Bedrocan BV (Veendam, Países Bajos) en el que se cultiva bajo condiciones estandarizadas de acuerdo a los requisitos de las Buenas Prácticas Agrícolas (BPA). Sólo se usaron flores femeninas (‘Cannabis Flos’). Después de la cosecha el material herbal se secó al aire en oscuridad bajo condiciones de temperatura y humedad constantes durante una semana. Las flores secas fueron limpiadas cuidadosamente para eliminar hojas y tallos, y finalmente fueron troceadas en fragmentos más pequeños. El mismo material de cannabis se dispensa oficialmente a través de las farmacias holandesas bajo el programa de cannabis medicinal de los Países Bajos, supervisado por la Oficina de Cannabis Medicinal (OCM). El material vegetal se homogeneizó por trituración y se almacenó a -20°C hasta su uso.

Químicos y disolventes
El etanol (tipo HPLC), el metanol (tipo HPLC), el ácido acético (tipo analítico) y el carbón activado (tipo analítico) fueron adquirieron de Sigma-Aldrich (Steinheim, Alemania). El éter de petróleo (punto de ebullición 40-65°C; tipo analítico) fue adquirido de Boom BV (Meppel, Países Bajos). La nafta (petróleo destilado tratado con hidrógeno ligero; combustible Coleman®) fue adquirido de Coleman Company (Wichita, EE.UU.). El aceite de oliva (de calidad virgen extra)fue comprado en una tienda de comestibles. El cloroformo deuterado (CDCl3) era de Eurisotop (Gif-surYvette, Francia). Los estándares etanólicos puros para el delta-9-tetrahidrocannabinol (THC) y el ácido delta9 tetrahidrocannabinólico (THCA) fueron producidos según fueron descritos previamente [16,17]. El papel de filtro de celulosa para la filtración de los extractos era de Whatman Ltd. (Maidstone, Reino Unido).
Efectos del precalentamiento
El precalentamiento de las muestras de cannabis ha sido recomendado como forma de potenciar el extracto final, es decir, para decarboxilar los ácidos cannabinoides presentes de forma natural en el material de la planta de cannabis, como son el THCA y el CBDA, y convertirlos en sus homólogos más potentes THC y CBD [18,19]. Por tanto, hemos probado dos métodos de decarboxilación por calentamiento del material herbal de cannabis (1g en un vial de vidrio abierto) bajo dos condiciones: I) al baño de agua (baño maría) a baja ebullición (temperatura de 98-100°C) durante 5
minutos, y II) en un horno calentado a 145°C durante 30 minutos. Como control para estos experimentos fueron usadas muestras sin calentar. Todos los exámenes se realizaron por duplicado. Posteriormente las muestras fueron extraídas según descritas anteriormente [20,21] y se analizaron mediante HPLC y GC.
Preparación de los extractos concentrados
Se evaluaron cinco protocolos de extracción diferentes para la preparación de los concentrados. Los detalles se
describen en la Tabla 1. Estos incluyen una extracción con nafta (1) y una con éter de petróleo (2) de acuerdo
con el procedimiento de Rick Simpson [12,13]; una extracción con etanol (3) basado en un sitio web holandés autorizado sobre aceite de cannabis [14] y dos con aceite de oliva con diferentes duraciones de calentamiento (4, 5) sobre la base de los populares vídeos de Youtube [15]. Químicamente los disolventes nafta y éter de petróleo son muy similares y a veces difíciles de distinguir debido a los muchos tipos diferentes disponibles. En el contexto de este estudio se seleccionó una nafta de calidad industrial que fue vendido como combustible de campamento (Coleman®) y que contenía productos químicos añadidos para mejorar su estabilidad, mientras que el éter de petróleo utilizado
fue de calidad de laboratorio y representaba un producto más puro y mejor caracterizado. Ambos disolventes pueden ser adquiridos por los enfermos sin experiencia bajo el nombre de nafta y éter de petróleo.
Todos los métodos de preparación consistieron en sólo unos pocos y simples pasos, por lo general relacionados con una o dos etapas de extracción, la separación de material vegetal del disolvente y, por último (en el caso de los disolventes orgánicos), una etapa de evaporación para producir un concentrado. Para la extracción con etanol (3) también probamos el efecto de la filtración a través de carbón activado para eliminar la clorofila que se extrae fuertemente con el etanol y que puede añadir un toque «verde» desagradable al extracto.
Ya que los distintos métodos de extracción utilizados dieron lugar a diferentes ratios planta-disolvente, todos los extractos se diluyeron finalmente en etanol para obtener una relación planta-disolvente de 2’5 mg/ml con el fin de permitir la comparación cromatográfica directa de los contenidos en cannabinoides y terpenos mediante cromatografía líquida de alto rendimiento (HPLC) y cromatografía de gases (GC).
Análisis GC/FID
Debido a la aplicación de calor durante la inyección y la separación, la GC no es capaz de mostrar la presencia de ácidos cannabinoides sin derivatización de la muestra. Como resultado la GC revela el contenido total de cannabinoides (cannabinoides neutros + ácidos) sólo después de la descarboxilación. Sin embargo, los terpenos pueden ser analizados de manera eficaz por GC. Por lo tanto se utilizó para el análisis de los terpenos del cannabis un GC Agilent de la serie 6890 (Agilent Technologies Inc., Santa Clara, CA, EE.UU.) equipado con un automuestreador 7683 y detector de ionización de llama (FID) como ya fue descrito con anterioridad [20,21] . El instrumento estaba equipado
con una columna capilar DB5 (30 m de longitud, 0’25 mm de diámetro interno, espesor de película 0’25 μm; J&W Scientific Inc., Folsom, CA, EE.UU.). La temperatura del inyector fue de 230°C, con un volumen de inyección de 4 μl, una relación de división de 1:120 y un gas portador (N2) con velocidad de flujo de 1’2 ml/min. El gradiente de temperatura se inició a 60°C y se incrementó a un ritmo de 3°C/min hasta 240°C que se mantuvo durante 5 minutos dando como resultado un tiempo de ejecución total de 65 minutos. La temperatura FID se ajustó a 250ºC. El GC fue controlado por
un programa Agilent GC Chemstation versión B.04.01.
Análisis HPLC
El perfil de cannabinoides fue estudiado con más detalle por HPLC, que permite diferenciar los cannabinoides ácidos (THCA, CBDA, etc.) de sus análogos neutros (THC, CBD, etc.) Los análisis se llevaron a cabo utilizando un sistema HPLC Agilent (Agilent Technologies Inc., Santa Clara, CA, EE.UU.) de la serie 1200, que consiste en una bomba G1310A, un
disolvente desgasificador G1322A, y un inyector automático G1329A. Se registró el espectro completo en el rango de 200-400 nm usando un detector de fotodiodo G1315D (PDA). La separación cromatográfica se consiguió utilizando una columna Phenomenex C18 (tipo Kinetex, 2.6 μm, 3×100 mm). El control del equipo, la adquisición de datos y la integración se realizaron con el programa Agilent Chemstation. La fase móvil consistió en metanol y agua, se acidificó con 25 mM de ácido fórmico. El ajuste inicial fue de 75% de metanol (v/v), que se aumentó linealmente hasta 100%
de metanol durante 10 minutos. Después de mantener esta condición durante 1 minuto, la columna se volvió a equilibrar en condiciones iniciales durante 4 minutos, lo que resultó un tiempo de ejecución total de 15 minutos. La velocidad de flujo se estableció a 0’5 ml/min, el volumen de inyección fue de 2 μL y la longitud de onda de detección de 228 nm. Todos los experimentos se llevaron a cabo a una temperatura de columna de 40ºC.
Análisis RMN
El análisis por Resonancia Magnética Nuclear de Protones (RMN-1H) para la detección de residuos del disolvente se llevó a cabo mediante la disolución de alícuotas de las muestras en cloroformo deuterado. Los espectros se registraron en un espectrómetro Bruker DPX 300MHz, tal como ha sido descrito con anterioridad [17].
Resultados y Discusión
Efectos del precalentamiento
En la planta de cannabis los cannabinoides son biosintetizados en sus formas ácidas, que se caracterizan por la presencia de un grupo carboxilo unido al anillo fenólico. Los ácidos cannabinoides se pueden convertir rápidamente en sus análogos ‘neutros’ bajo la influenciadel calor o del almacenamiento prolongado [18], lo que causa la pérdida del grupo carboxilo relativamente inestable en forma de dióxido de carbono (descarboxilación). La preparación del aceite de cannabis, principalmente destinado para uso oral, por lo general implica temperaturas que son relativamente bajas en comparación con otras formas de administración donde la calefacción de la materia se lleva a cabo típicamente a
temperaturas mucho más altas (por ejemplo, fumar, vaporizar u hornear). Para una descarboxilación más a fondo, se ha sugerido el precalentamiento del cannabis herbal antes de la preparación del aceite de cannabis, por ejemplo mediante la introducción del cannabis en un horno.
Además de los cannabinoides, la planta de cannabis contiene un rango de terpenos que son los compuestos volátiles que dan al cannabis su característico olor y puede actuar sinérgicamente con los cannabinoides [10]. Aunque el precalentamiento del material de la planta puede liberar más cannabinoides activos (neutros) que los conocidos, al mismo tiempo puede también causar la pérdida por degradación o evaporación de componentes como los terpenos.
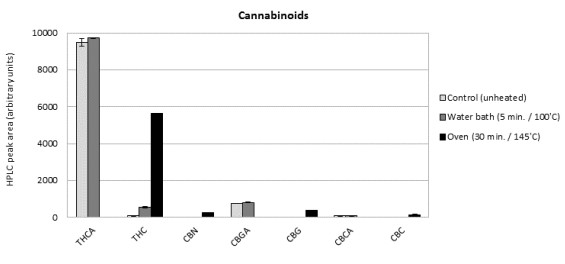
Nuestras pruebas estaban destinadas a aclarar mejor el equilibrio entre la decarboxilación deseada y la degradación indeseada. Como control se utilizó cannabis no calentado. La Figura 1A muestra el perfil de cannabinoides de las
muestras descarboxiladas, obtenidas por análisis HPLC. El tratamiento al baño maría ligero no condujo
a cambios significativos en la relación entre cannabinoides ácidos y neutros. En cambio, el tratamiento en un horno dio como resultado una descarboxilación completa de los principales cannabinoides detectados.
El THCA, el ácido cannabigerólico (CBGA) y el ácido cannabicroménico (CBCA) se habían convertido completamente en THC, cannabigerol (CBG) y cannabicromeno (CBC), respectivamente. La conversión adicional de THC en su principal producto de degradación cannabinol (CBN) se llevó a cabo sólo en pequeño grado durante el tratamiento en horno.
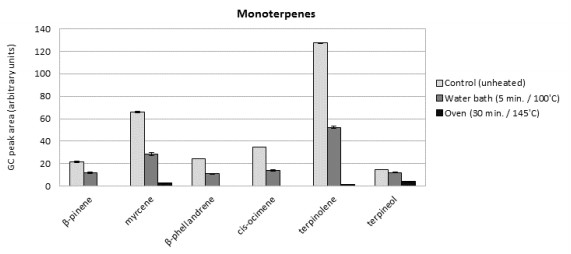
Las Figuras 1B y 1C muestran el perfil de terpenos de nuestras muestras descarboxiladas utilizando GC. En
comparación con el control sin tratar, los monoterpenos (los terpenos más volátiles) se redujeron aproximadamente a la mitad de sus niveles originales incluso después de exponer el material vegetal al baño maría durante sólo 5 min. Después de un tratamiento más intenso en horno, podían aun ser detectados solamente pequeñas trazas de los monoterpenos terpineol, mirceno y terpinoleno. Como era de esperar los sesquiterpenos fueron menos volátiles, más resistentes al tratamiento suave al baño maría. Sin embargo, la mayoría de ellos se perdieron en el tratamiento en horno, y sólo quedaron trazas de gamma-cadineno y eudesma-3,7(11)-dieno.
Estos datos indican que la descarboxilación significativa de los principales ácidos cannabinoides ocurre sólo por exposición a temperaturas más altas durante tiempo prolongado (horno a 145°C durante 30 minutos), lo cual concuerda con estudios anteriores [18,22]. Sin embargo en estas condiciones la mayor parte de los
terpenos presentes fueron afectados por una importante evaporación. Aunque la descarboxilación suave puede
ser eficaz usando el baño maría cuando se aplica durante más tiempo [22], el perfil de terpenos ya cambia de manera significativa después de sólo 5 minutos de tratamiento. Por esta razón, todos los otros experimentos se llevaron a cabo sin la aplicación de una etapa de precalentamiento.
Análisis de los extractos: contenido de cannabinoides y terpenos
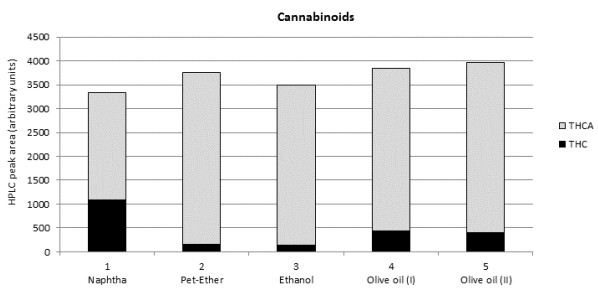
El análisis por HPLC para revelar la relación entre los cannabinoides ácidos y los neutros en los diferentes extractos se limita a los principales cannabinoides THCA y THC. Los resultados se muestran en la Figura 2A. La mayoría contenían sólo una pequeña cantidad de THC (contenido 5-10% del total de THCA + THC), como resultado del relativo bajo calor (máximo de 100°C) aplicado durante los pasos de evaporación (protocolo 1-3) y extracción (protocolo 4-5). Una excepción notable fue el extracto de nafta, que contenía 33% del total de THCA + THC presente en forma de THC.

sesquiterpene (análisis GC) en el material herbal de cannabis. (THCA: ácido tetrahidrocannabinólico; THC:
tetrahidrocannabinol; CBN: cannabinol; CBGA: ácido cannabigerólico; CBG: cannabigerol; CBCA: ácido cannabicroménico;
CBC: cannabicromeno)


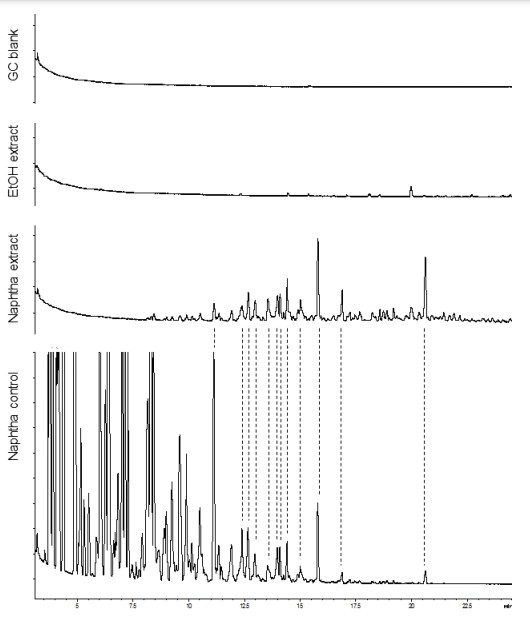
comparación hemos añadido las líneas de puntos. Todos los cromatogramas se muestran en la misma escala.

de tiempo mayor para comparar el área de pico total de los componentes de nafta y el de los sesquiterpenos presentes en estas
muestras.
Esto es importante porque el extracto preparado con éter de petróleo no mostró la misma composición, a pesar de que ambos disolventes son químicamente muy similares. Tal vez pudo ser el responsable de la diferencia observada químicos añadidos (por ejemplo, para la estabilidad) en la nafta utilizado en este estudio.
El análisis de los extractos mediante GC indicó que los principales componentes presentes en el material de cannabis usado fueron los monoterpenos beta-pineno, mirceno, beta-felandreno, cis-ocimeno, terpinoleno y terpineol, y los sesquiterpenos beta-cariofileno, humuleno, delta-guaieno, gamma-cadineno, eudesma-3,7(11)-dieno y elemeno. Esto concuerda con informes anteriores de la variedad cannabis ‘Bedrocan’ [20,21].
Los disolventes usados mostraron eficiencia similar para la extracción de los terpenos, con la notable excepción de la nafta (Figura 2B y 2C). Mientras que este disolvente extrae generalmente terpenos de forma menos eficaz que los otros disolventes, no pudieron ser detectados en absoluto varios terpenos en el extracto de nafta. No se sabe si (i) estos componentes no se extrajeron a partir del material vegetal, (ii) son degradados o evaporados durante el proceso de extracción, o (iii) los tiempos de retención GC para estos componentes se han cambiado como resultado de la interacción con los componentes del disolvente. Curiosamente, el uso del éter de petróleo (químicamente muy similar a la nafta) no mostró la misma ausencia de componentes.
Se vio que el aceite de oliva usado como disolvente extractor es más beneficioso basado en el hecho de que extrae más grandes cantidades de terpenos que otros disolventes/métodos, especialmente cuando se usa un tiempo de calentamiento prolongado (120 minutos; protocolo 5). Esto puede explicarse por el carácter altamente no polar pero también no volátil de aceite de oliva, lo que da lugar a una buena solubilidad de los terpenos limitando al mismo tiempo su pérdida por evaporación.
El tratamiento del extracto etanólico con carbón activado, que sirve para eliminar la clorofila, dio lugar a una reducción considerable del contenido de cannabinoides (~50%), así como de todos los otros componentes de la muestra (datos no mostrados). Por esta razón no se recomienda el uso de carbón y no se evaluó adicionalmente en nuestro estudio.
Detección de residuos del disolvente
La nafta y el éter de petróleo son mezclas de varios disolventes hidrocarburos con una amplia gama de puntos de ebullición, generalmente entre 30 a 200°C.
Todos los componentes disolventes deben ser considerados inflamables, y algunos de ellos como el hexano
y el benceno pueden ser neurotóxicos. Ambos, nafta y éter de petróleo, son considerados cancerígenos según
sus respectivas Fichas de Datos de Seguridad de Materiales (MSDS) proporcionadas por sus fabricantes. Además, los productos vendidos como nafta pueden contener impurezas añadidas (por ejemplo, para aumentar la estabilidad) que pueden tener propiedades nocivas por sí mismas [23]. Por estas razones se analizaron los extractos de éter de petróleo y nafta respecto al contenido de disolvente residual.
El análisis por GC y RMN reveló residuos significativos de hidrocarburos de petróleo (HCPs) en los extractos de éter de petróleo y nafta. Como era de esperar, principalmente los HCPs con un punto de ebullición más alto (como se indica por los más largo tiempos de retención GC) ya que son más resistentes al proceso de evaporación utilizado (Figura 3A). En el extracto de nafta, sobre la base de las áreas de pico GC, el contenido de residuo de nafta era más o menos similar al contenido total de terpenos que queda en el extracto (Figura 3B).
Reconfirmación usando una muestra de paciente
Con el fin de confirmar nuestros resultados experimentales, también se analizó una muestra proporcionada por un paciente de los Países Bajos que produce su propio aceite de cannabis usando cannabis Bedrocan® y siguiendo el método de Simpson como se describe en Internet. El paciente, un varón de 50 años, padecía cáncer de amígdala (izquierda) y lengua. Los datos analíticos (resultados no mostrados) fueron equivalentes a los experimentos de nuestro laboratorio descritos más arriba, lo que confirma la presencia residual de HCPs en concentraciones significativas en un producto destinados a la automedicación del cáncer.
Conclusiones
Los extractos de cannabis concentrados, también conocidos como aceites de cannabis, son mencionados cada vez más por pacientes que se automedican como cura para el cáncer. A pesar de esta creciente popularidad,
hasta el momento no se han publicado estudios sobre la composición química o sus diferentes métodos de preparación. Reconociendo la necesidad de más información sobre los problemas de calidad y seguridad con respecto a los aceites de cannabis, el pequeño estudio aquí presentado compara algunas recetas habituales utilizadas para la elaboración de aceites de cannabis analizando el contenido de cannabinoides, terpenos y disolvente residual.
Sobre la base de los resultados de nuestros experimentos de precalentamiento, la comparación de un tratamiento suave al baño maría y un calentamiento más intenso en horno, se puede concluir que no es factible realizar la descarboxilación de los cannabinoides sin pérdida significativa de terpenos. Esto es particularmente importante debido al hecho de que los usuarios de los aceites de cannabis suelen afirmar el carácter global de todos los componentes del cannabis como responsable del efecto terapéutico. La conservación del espectro de terpenos presente en el material de cannabis fresco debe, por tanto, ser un objetivo importante en la producción óptima del aceite de cannabis.
Al comparar cinco métodos de preparación de aceite de cannabis, se observaron algunas diferencias interesantes entre los extractos resultantes. En concreto, el método de preparación descrito por Rick Simpson ha atraído mucho a seguidores enfermos automedicados.
Este método favorece el uso de la nafta como disolvente para la extracción de cannabinoides, sin especificar las cuestiones relativas a la calidad o la seguridad. Según el sitio web de Simpson: «Todos estos disolventes […] son tóxicos por naturaleza, pero si usted sigue estas instrucciones no hay que preocuparse por los residuos del disolvente en el aceite final. […] Incluso si queda una cantidad importante de trazas de residuo de disolvente, el propio aceite actuaría sobre él para neutralizar cualquier efecto tóxico perjudicial.» [13].
En otras palabras, se consideran las propiedades curativas lo suficientemente fuerte como para contrarrestar cualquier (y todo) posible efecto negativo causado por los disolventes residuales. El análisis químico de las muestras de laboratorio, así como una muestra obtenida de un paciente, mostró que la fracción pesada (con componentes de alto punto de ebullición) de la nafta de hecho permanece en el extracto a pesar de la etapa de la evaporación recomendada. Basándonos en las áreas de pico GC-FID, el contenido total de HCPs es más o menos igual que el contenido total de terpenos presentes en el extracto. Los potenciales efectos perjudiciales de estos residuos de disolventes ya han sido analizados antes.
Cabe señalar que, como resultado de la viscosidad de la muestra, mientras más concentrado llega a ser un extracto más difícil será eliminar su disolvente residual. En tal caso la aplicación de más calor aumentará la evaporación, pero al mismo tiempo se perderá también más terpenos. Siempre hay una pérdida de terpenos a cambio de una menor cantidad de residuos del disolvente, especialmente cuando el aceite de cannabis seelabora con métodos simples caseros. Por esta razónsiempre debe recomendarse el uso de disolventes no tóxicos para que los potenciales residuos no sean perjudiciales para la salud.
Como disolventes de extracción para la producción de aceites de cannabis, el etanol y el aceite de oliva son
mucho mejores, quedando probada la eficaz extracción de todos los terpenos y cannabinoides. Además, estos
disolventes no son perjudiciales. Por desgracia el etanol puro extrae mucha clorofila del cannabis, lo que da al extracto final un color verde distinto y a menudo un desagradable sabor. La extracción de la clorofila por filtrado del extracto de etanol mediante carbón activado es muy eficaz, peor también elimina una gran proporción de cannabinoides y terpenos, y por tanto no es aconsejable. Además, en la mayoría de los países el etanol para consumo es un disolvente caro como consecuencia de los impuestos que gravan los productos alcohólicos.
De los disolventes probados, el aceite de oliva es la opción más óptima para la preparación de aceites de cannabis para automedicación. Es barato, no inflamable ni tóxico, y tiene que ser calentado sólo hasta el punto de ebullición del agua (al baño maría: metiendo el producto en un recipiente de vidrio y este en una cacerola con agua hirviendo) por lo que no es posible el sobrecalentamiento del aceite. Después de enfriar y filtrar el aceite, por ejemplo mediante el uso de una cafetera de prensa francesa, el producto está inmediatamente listo para el consumo. Como contrapartida, sin embargo, el extracto de aceite de oliva no puede ser concentrado por evaporación, lo que significa que los pacientes tendrán que consumir un volumen más grande del misma para obtener los mismos efectos terapéuticos. Para un estudio de seguimiento sobre el uso de aceites de cannabis, debería prestarse más atención a las características y motivaciones de las personas que lo utilizan como automedicación.
Agradecimientos
LR fue financiado para esta investigación por el gobierno regional de Puglia (Italia) mediante una subvención «Ritorno al futuro». AH es el jefe de Investigación y Desarrollo de Bedrocan BV, Países Bajos.
Referencias
- Guzmán M. Cannabinoids: potential anticancer
agents. Nat. Rev. Cancer. 2003; 3(10): 745-755. - Calvaruso G, Pellerito O, Notaro A, Giuliano M.
Cannabinoid-associated cell death mechanisms in
tumor models (review). Int. J. Oncol. 2012;
41(2): 407-413. - Velasco G, Sánchez C, Guzmán M. Towards the
use of cannabinoids as antitumour agents. Nat.
Rev. Cancer 2012; 12(6): 436-444. - Dansak DA. Cannabis as an antiemetic and appetite stimulant in cancer patients. McFarland &
Co.: Jefferson, NC, 1997; pp 69-83. - Plasse TF, Gorter RW, Krasnow SH, Lane M,
Shepard KV, Wadleigh RG. Recent clinical experience with dronabinol. Pharmacol. Biochem.
Behav. 1991; 40(3): 695-700. - Noyes R, Baram DA. Cannabis analgesia. Comprehensive Psychiatry 1974; 15(6): 531-535.
- Clifford DB. Tetrahydrocannabinol for tremor in
multiple sclerosis. Ann. Neurol 1983; 13(6): 669-
671. - Müller-Vahl KR, Kolbe H, Schneider U, Emrich
HM. Cannabis in movement disorders. Forsch.
Komplementärmed. 1999; 6 (Suppl 3): 23-27. - Guzman M 2012. Do cannabinoids cure cancer?
IACM website: http://www.cannabismed.org/index.php?tpl=faq&red=faqlist&id=274
&lng=en - Russo EB. Taming THC: potential cannabis synergy and phytocannabinoid-terpenoid entourage
effects. Br. J. Pharmacol. 2011; 163: 1344-1364. - Grotenhermen F. Pharmacokinetics and pharmacodynamics of cannabinoids. Clin. Pharmacokin.
2003; 42(4): 327-360. - Simpson R. 2008. Documentary film: Run from
the cure. Available on youtube.
http://www.youtube.com/watch?v=0psJhQHk_GI - Simpson R. 2013: Rick Simpson official website:
http://phoenixtears.ca/ - Bruining W. 2013. Wernard Bruining. Mediwiet
[Medi-weed] official website:
http://www.mediwiet.nl - Dr. Diane. 2013. Youtube instruction video:
http://www.youtube.com/watch?v=vs66uyiH968 - Hazekamp A, Simons R, Peltenburg-Looman A,
Sengers M, Van Zweden R, Verpoorte R. Preparative isolation of cannabinoids from Cannabis sativa by centrifugal partition chromatography. J.
Liq. Chrom. Rel. Technol. 2004; 27: 2421-2439. - Hazekamp A, Choi YH, Verpoorte R. Quantitative analysis of cannabinoids from Cannabis sativa using 1H-NMR. Chem. Pharm. Bull. 2004;
52(6): 718-721. - Veress T, Szanto JI, Leisztner L. Determination
- of cannabinoid acids by high-performance liquid
- chromatography of their neutral derivatives
- formed by thermal decarboxylation in an open reactor. J. Chromatogr. 1990; 520: 339-347.
- Hazekamp A, Bastola, K Rashidi H, Bender J,
- Verpoorte R. Cannabis tea revisited: A systematic
- evaluation of the cannabinoid composition of
- cannabis tea. J. Ethnopharm. 2007; 113: 85-90.
- Fischedick JT, Hazekamp A, Erkelens T, Choi
- YH, Verpoorte R. Metabolic fingerprinting of
- Cannabis sativa L., cannabinoids and terpenoids
- for chemotaxonomic and drug standardization
- purposes. Phytochem. 2010; 71(17-18): 2058-
- 2073.
- Hazekamp A, Fischedick JT. Cannabis – from
- cultivar to chemovar. Towards a better definition
- of cannabis potency. Drug Testing and Analysis
- 2012; 4: 660-667.
- Fischedick JT, Glas R, Hazekamp A, Verpoorte
- R. A Qualitative and Quantitative HPTLC Densitometry Method for the Analysis of Cannabinoids
- in Cannabis sativa L. Phytochem. Anal. 2009; 20;
- 421-426.
- IARC 1989: WHO International Agency for
- Research on Cancer. IARC monographs on the
- evaluation of carcinogenic risks to humans. Volume 47.
- http://monographs.iarc.fr/ENG/Monographs/vol4
- 7/mono47.pdf
Este artículo puede ser descargado, imprimido y distribuido de forma gratuita con fines no lucrativos, siempre que el trabajo original sea correctamente citado (ver información sobre copyright más abajo). Disponible on-line en www.cannabis-med.org